题目内容
【题目】用含有二氧化碳和水蒸气杂质的某还原性气体(氢气和一氧化碳中的一种)测定一种铁的氧化物(FexOy)的组成,实验装置如图所示:
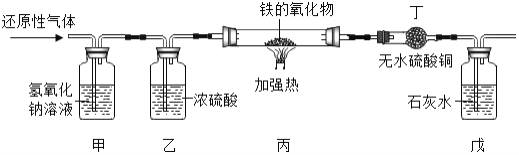
根据图回答下列问题:
(1)甲装置发生反应的化学方程式是______;
(2)实验过程中丁装置白色粉末变蓝色,而戊装置中溶液没有明显变化,则该还原性气体是______
(3)当丙装置中的FexOy全部被还原后,称量剩余固体的质量为11.2g,同时测得丁装置的质量增加了5.4g。则该铁的氧化物的化学式为______。
(4)上述实验中,如果没有乙装置,将使测定结果中铁元素与氧元素的质量的比值______(填“偏大”、“偏小”或“无影响”)。
【答案】CO2+2NaOH=Na2CO3+H2O 氢气 Fe2O3 偏小
【解析】
(1)因二氧化碳能与氢氧化钠反应,通过甲装置可以除去,所以甲装置发生反应的化学方程式是:2NaOH+CO2═Na2CO3+H2O;
(2)实验过程中丁装置白色粉末变蓝色,而戊装置中溶液没有明显变化,说明了该反应有水生成,没有二氧化碳生成,则该还原性气体是氢气;
(3)丙装置中的FexOy全部被还原,剩余固体为生成的铁的质量。丁装置中盛放无水硫酸铜吸收水,增加的质量为水的质量,所以:

![]() ,
,
![]() ,
,
所以该铁的氧化物的组成为:Fe2O3
(4)如果没有乙装置,混有的水蒸气被吸收丁装置,故生成水质量偏大,相当于氢气夺得的氧的质量增加,故测得结果中铁元素与氧元素的质量的比值偏小。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目