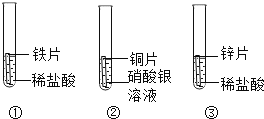
题目内容
【题目】某兴趣小组同学在实验室对粗盐样品中难溶性杂质进行了去除,流程如图1:
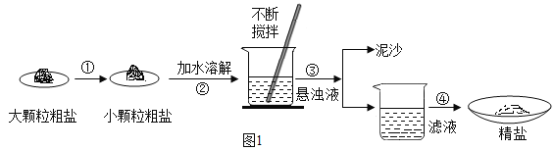
(1)操作①的目的是_________;操作③的名称是______;操作④用蒸发结晶而不用降温结晶的理由是________。
(2)用提纯得到的“精盐”配制的氯化钠溶液,经检测,溶质质量分数偏小,其原因一定有_________(填序号)。
A 量取水时俯视读数
B 称量时精盐与砝码放反了
C 量取水时仰视读数
D 装瓶时有少量溶液洒出
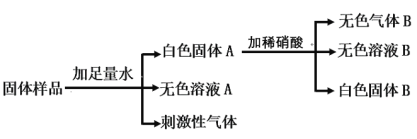
(3)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有一种氯化镁),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理如图2:
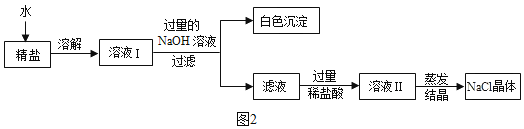
①生成白色沉淀的化学方程式为____________。
②溶液Ⅱ蒸发结晶的目的是除去_____________(填物质的化学式)。
③若实验过程中不考虑损耗最终到的NaCl固体的质量将_________(填“大于”、“小于”或“等于”)原精盐中NaCl的质量。
【答案】加快粗盐溶解速率 过滤 NaCl的溶解度受湿度变化的影响很小 C ![]() H2O、HCl 大于
H2O、HCl 大于
【解析】
(1)操作①用玻璃棒不断搅拌的目的是:加快粗盐溶解速率;操作③将固体与液体分离的名称是:过滤;操作④用蒸发结晶而不用降温结晶的理由是:NaCl的溶解度受湿度变化的影响很小;
(2)用提纯得到的“精盐”配制的氯化钠溶液,经检测,溶质质量分数偏小,其原因一定有 A、量取水时俯视读数,则实际量取水的体积偏小,导致质量分数偏大;故选项错误;
B、称量时精盐与砝码放反了,若没有使用游码,则实际称量精盐的质量准确,质量分数不变;故选项错误;
C、量取水时仰视读数,则实际量取水的体积偏大,导致质量分数偏小;故选项正确;
D、装瓶时有少量溶液洒出,此时溶液配制完成,质量分数不变;故选项错误;
故选:C。
(3)
①氯化镁和氢氧化钠反应生成白色沉淀氢氧化镁和氯化钠溶液的化学方程式为:![]() 。
。
②溶液Ⅱ中含有过量的稀盐酸,蒸发结晶得到氯化钠晶体,的目的是除去氯化氢(HCl)和水(H2O)。
③若实验过程中不考虑损耗最终到的NaCl固体的质量将大于原精盐中NaCl的质量,因为:氯化镁和氢氧化钠反应产生更多的氯化钠溶液。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案