题目内容
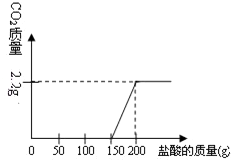 某中学实验室一小瓶氢氧化钠变质后质量为18.3g(假设只有氢氧化钠、碳酸钠和水三种物质),现将其配成102.2g溶液,向其中滴入稀盐酸.滴加过程中产生的二氧化碳的质量与加入的稀盐酸的质量之间的关系如图所示.试计算:
某中学实验室一小瓶氢氧化钠变质后质量为18.3g(假设只有氢氧化钠、碳酸钠和水三种物质),现将其配成102.2g溶液,向其中滴入稀盐酸.滴加过程中产生的二氧化碳的质量与加入的稀盐酸的质量之间的关系如图所示.试计算:(1)每50g所用稀盐酸中含溶质
(2)18.3g中没有变质的氢氧化钠质量.
(3)恰好完全反应时溶质的质量分数.
分析:本题中所涉及的反应为碳酸钠和盐酸的反应以及氢氧化钠和盐酸反应,结合图象可以知道,与氢氧化钠反应的盐酸的质量为150g,与碳酸钠反应的盐酸的质量为50g,生成二氧化碳的质量为2.2g,可以据此求出稀盐酸中溶质的质量,并求出反应后溶液中溶质的质量分数.
解答:解:(1)设50 g 盐酸中含HCl的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 117 44
x y 2.2 g
=
=
解得:x=3.65g,y=5.85g
(2)与氢氧化钠反应的稀盐酸的质量为150g所以其中含有的溶质的质量为:3.65g×3=10.95g
18.3g中没有变质的氢氧化钠质量z,生成氯化钠的质量为a.
NaOH+HCl═NaCl+H2O
40 36.5 58.5
z 10.95g a
=
=
z=12g,a=17.55g
(3)最终生成氯化钠的质量为:5.85g+17.55g=23.4g
恰好反应时溶质的质量分数为:
×100%=7.8%
答:(2)18.3g中没有变质的氢氧化钠质量为12g.
(3)恰好完全反应时溶质的质量分数为7.8%.
故答案为:(1)3.65g;
(2)12g;
(3)7.8%.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 117 44
x y 2.2 g
| 73 |
| x |
| 117 |
| y |
| 44 |
| 2.2g |
解得:x=3.65g,y=5.85g
(2)与氢氧化钠反应的稀盐酸的质量为150g所以其中含有的溶质的质量为:3.65g×3=10.95g
18.3g中没有变质的氢氧化钠质量z,生成氯化钠的质量为a.
NaOH+HCl═NaCl+H2O
40 36.5 58.5
z 10.95g a
| 40 |
| z |
| 58.5 |
| a |
| 36.5 |
| 10.95g |
z=12g,a=17.55g
(3)最终生成氯化钠的质量为:5.85g+17.55g=23.4g
恰好反应时溶质的质量分数为:
| 23.4g |
| 102.2g+200g-2.2g |
答:(2)18.3g中没有变质的氢氧化钠质量为12g.
(3)恰好完全反应时溶质的质量分数为7.8%.
故答案为:(1)3.65g;
(2)12g;
(3)7.8%.
点评:本题主要考查学生运用化学方程式和质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
 实验室有一瓶氢氧化钾浓溶液,瓶上标签内容如图所示,请你根据签上提供的数据解答下列问题:
实验室有一瓶氢氧化钾浓溶液,瓶上标签内容如图所示,请你根据签上提供的数据解答下列问题: (2011?南平)食品安全,关乎民生.食品脱氧剂(以活性铁粉为主的物质组成)能通过化学反应除去密闭包装袋中的氧气,使食品处于无氧状态,有效控制细菌、霉菌的生长,以保持食品的色、香、味.
(2011?南平)食品安全,关乎民生.食品脱氧剂(以活性铁粉为主的物质组成)能通过化学反应除去密闭包装袋中的氧气,使食品处于无氧状态,有效控制细菌、霉菌的生长,以保持食品的色、香、味. 实验室有一瓶氢氧化钾浓溶液,瓶上标签内容如图所示,请你根据签上提供的数据解答下列问题:
实验室有一瓶氢氧化钾浓溶液,瓶上标签内容如图所示,请你根据签上提供的数据解答下列问题: