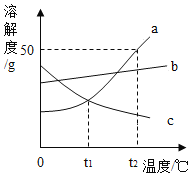
题目内容
【题目】金属材料广泛应用于生产生活中。
(1)下列金属制品中,利用金属导热性的是_____(填字母编号)。
A金属硬币 B铝制导线 C铜制火锅
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化,写出铝与氧气反应的化学方程式:_____。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是_____(写化学式)。
(4)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式_____。
②冶炼4000t含Fe2O380%的赤铁矿石,理论上能得到含杂质2%的生铁的质量是_____(结果精确到0.1)。
【答案】C 4Al+3O2=2Al2O3 ZnCl2和FeCl2 Fe2O3+3CO![]() 2Fe+3CO2 2285.7t
2Fe+3CO2 2285.7t
【解析】
(1)金属做硬币是利用其硬度大,耐磨的性质,铝制导线是利用了铝的导电性,铜制火锅是利用了铜的导热性,故填:C;
(2)铝在空气中与氧气形成一层致密的氧化物薄膜的反应是铝与氧气反应生成氧化铝,化学方程式为:4Al+3O2=2Al2O3,故填:4Al+3O2=2Al2O3;
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,根据金属活动性顺序,位置远的先发生反应,前面的可以将后面的置换出来,所以铁不能与氯化锌反应,铁先与氯化铜反应,反应结束后才会与稀盐酸反应,由于加入的铁粉是过量的,所以氯化铜与稀盐酸都会反应完全,且反应后都生成氯化亚铁,充分反应后过滤,滤液中含有的溶质是氯化锌和氯化亚铁,故填:ZnCl2和FeCl2;
(4)①赤铁矿石中的主要成分是氧化铁,它与一氧化碳反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2,故填:Fe2O3+3CO
2Fe+3CO2,故填:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
②设理论上能得到含杂质2%的生铁的质量是x,氧化铁中铁元素的质量分数为![]() ×100%=70%,根据元素守恒可知4000t×80%×70%=x×(1-2%),
×100%=70%,根据元素守恒可知4000t×80%×70%=x×(1-2%),
x≈2285.7t,
故填: 2285.7t。

【题目】某混合溶液含一定量的硝酸银、硝酸铜和硝酸钡,为逐一沉淀分离其中的金属元素,从稀盐酸、稀硫酸、氢氧化钠稀溶液、氯化钠溶液、硫酸钠溶液中选择试剂进行实验。
①甲的实验如下表所示:
步骤 | 操作 | 现象与解释 |
Ⅰ | 向混合溶液中加入过量稀盐酸,充分反应后过滤 | 得到白色沉淀,相应的化学方程式是_______ |
Ⅱ | 向Ⅰ中滤液加入过量稀硫酸,充分反应后过滤 | 得到_______色沉淀 |
Ⅲ | 向Ⅱ中滤液加入过量氢氧化钠稀溶液,充分反应后过滤 | 得到蓝色沉淀,该沉淀的化学式是_______ |
在Ⅱ中,需确认钡元素是否完全沉淀。甲在此环节的部分实验记录如下图所示:

请根据这部分记录,指出该环节中甲存在的具体问题并说明理由。__________
②乙仅调整了甲实验中所加试剂的顺序,既达到了实验目的,理论上又减少了氢氧化钠的消耗量。乙所加试剂依次为 _________
③丙设计了一种新的方案,不仅达到了实验目的,而且理论上氢氧化钠的消耗量减到最少丙所加试剂依次为 ______