题目内容
【题目】某混合溶液含一定量的硝酸银、硝酸铜和硝酸钡,为逐一沉淀分离其中的金属元素,从稀盐酸、稀硫酸、氢氧化钠稀溶液、氯化钠溶液、硫酸钠溶液中选择试剂进行实验。
①甲的实验如下表所示:
步骤 | 操作 | 现象与解释 |
Ⅰ | 向混合溶液中加入过量稀盐酸,充分反应后过滤 | 得到白色沉淀,相应的化学方程式是_______ |
Ⅱ | 向Ⅰ中滤液加入过量稀硫酸,充分反应后过滤 | 得到_______色沉淀 |
Ⅲ | 向Ⅱ中滤液加入过量氢氧化钠稀溶液,充分反应后过滤 | 得到蓝色沉淀,该沉淀的化学式是_______ |
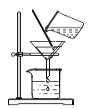
在Ⅱ中,需确认钡元素是否完全沉淀。甲在此环节的部分实验记录如下图所示:

请根据这部分记录,指出该环节中甲存在的具体问题并说明理由。__________
②乙仅调整了甲实验中所加试剂的顺序,既达到了实验目的,理论上又减少了氢氧化钠的消耗量。乙所加试剂依次为 _________
③丙设计了一种新的方案,不仅达到了实验目的,而且理论上氢氧化钠的消耗量减到最少丙所加试剂依次为 ______
【答案】AgNO3+HCl=AgCl↓+HNO3 白 Cu(OH)2 步骤Ⅰ中有过量的稀盐酸,故当pH小于7时,不能证明一定是稀硫酸过量,故不能证明钡离子被反应完了 稀盐酸、氢氧化钠、稀硫酸 氯化钠、硫酸钠、氢氧化钠
【解析】
①Ⅰ稀盐酸与硝酸银反应生成氯化银沉淀和硝酸,反应的方程式为:AgNO3+HCl=AgCl↓+HNO3
Ⅱ稀硫酸与硝酸钡反应生成白色的硫酸钡沉淀。
Ⅲ氢氧化钠与硝酸铜反应生成氢氧化铜沉淀和硝酸钠,反应的方程式为:2 NaOH+ Cu(NO3)2=2NaNO3+Cu(OH)2↓。步骤Ⅰ中有过量的稀盐酸,故当pH小于7时,不能证明一定是稀硫酸过量,故不能证明钡离子被反应完了。
②先加稀盐酸除去硝酸银,在加氢氧化钠除去硝酸铜,最后加入稀硫酸除去硝酸钡,可以减少过量的稀硫酸消耗氢氧化钠,不能一开始就加入氢氧化钠,因为氢氧化钠也可以与硝酸银反应生成沉淀,不能使沉淀逐一分离。
③为了减少氢氧化钠的使用量,可以先加入氯化钠除去硝酸银,在加入硫酸钠除去硝酸钡,最后加入氢氧化钠除去硝酸铜,使用过量的氯化钠和硫酸钠变化消耗氢氧化钠。

【题目】类价二维图反映的是元素的化合价与物质类别之间的关系,构建类价二维图是化学学习的重要方法。图1是某同学绘制的关于碳元素的类价二维图。
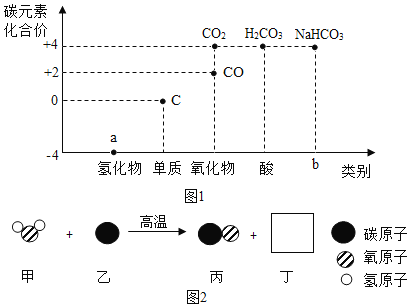
(1)a处氢化物为天然气的主要成分,其化学式为_______:b处对应物质的类别是_______。
(2)煤的主要成分是单质碳。图2是用煤合成水煤气的反应微观示意图。该反应中方框丁中微粒的图示为_______,甲对应的物质表现出了_______性。
(3)类价二维图中的物质在一定条件下可以相互转化。请从含碳物质中选择合适物质完成下列表格:
转化类型 | 转化的化学方程式 | 反应用途 |
碳元素化合价升高 | _______ | 工业炼铁 |
碳元素化合价不变 | NaHCO3+HCl=NaCl+CO2↑+H2O | _______ |