题目内容
【题目】在探究金属与酸的反应时,发现铜片与 20%的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应”,并进行了系列实验。
(查阅资料)SO2 能让红色的品红溶液褪色,能被 NaOH 溶液吸收。
(进行实验)(夹持仪器略)
实验 1:初步实验(所用溶液均为硫酸溶液)
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 | 1-5 |
装置 |
|
|
|
|
|
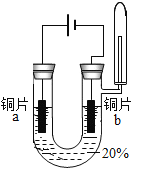
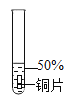
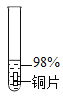
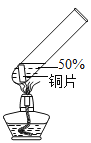
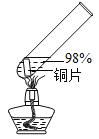
主要现象 | 铜片 a 附近溶液逐渐变 蓝,铜片 b 附近产生无 色气泡。 | 无明显现象 | 无明显现象 | 无明显现象 | 铜片溶解,溶液变蓝,生成有刺激性气味的无色气体 |
经检验实验 1-1 中产生的气体是氢气。
实验 2:在实验 1-5 的基础上深入探究,装置如图。
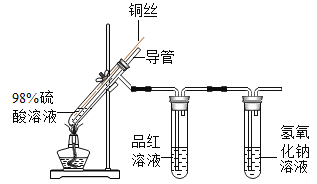
(解释与结论)
(1)实验 1-1 中, 能证明铜发生反应的现象是__________________。
(2)实验 1 中,欲得出“升高温度可使铜与硫酸反应” 需对比的实验是______________(填实验序号)。
(3)实验 1-5 和实验 2 中,推测放出的气体含 SO2,从元 素守恒的说明理由:_________________。
(4)实验 2 中,能证明有 SO2 生成的实验现象是______________。
(5)补全实验 1-5 和实验 2 中铜与硫酸反应的化学方程式:Cu +2H2SO4(浓)![]() CuSO4+SO2↑+______________。
CuSO4+SO2↑+______________。
(反思与评价)
(6)下列说法不正确的是______________。
A对比实验 1-2 和 1-5,可得出“增大浓度可使铜与硫酸反应”
B通电可促进一些化学反应的发生
C铜与硫酸只能发生一种化学反应
【答案】溶液变蓝 1-3和1-5 反应前硫酸中含有硫元素和氧元素,则生成物中也含有硫元素和氧元素 品红溶液褪色 2H2O AC
【解析】
铜和浓硫酸反应生成硫酸铜、水和二氧化硫。
(1)化学变化的实质是有新物质生成,铜片a附近溶液逐渐变蓝,说明生成铜离子,故实验1-1中, 能证明铜发生反应的现象是溶液变蓝。
(2)实验1中,欲得出“升高温度可使铜与硫酸反应”,除了温度这个变量之外其他的变量都要相同,1-3和1-5温度不同,溶液浓度相同,1-5铜片溶解,溶液变蓝,生成有刺激性气味的无色气体,说明发生反应,故需对比的实验是1-3和1-5。
(3)由质量守恒定律可知,反应前后元素的种类不变,SO2 能让红色的品红溶液褪色,实验1-5和实验2中,放出的气体含SO2,理由是反应前硫酸中含有硫元素和氧元素,则生成物中也含有硫元素和氧元素。
(4)SO2 能让红色的品红溶液褪色,故实验2中,能证明有SO2生成的实验现象是品红溶液褪色。
(5)由质量守恒定律可知,反应前后元素的种类和原子个数不变,反应物中有1个铜原子、4个氢原子、2个硫原子和8个氧原子,生成物中有1个铜原子、2个硫原子和6个氧原子,故实验1-5和实验2中铜与硫酸反应的化学方程式为Cu +2H2SO4(浓)![]() CuSO4+SO2↑+ 2H2O。
CuSO4+SO2↑+ 2H2O。
(6)A、在进行实验对比的时候,要控制只有一个变量,实验1-2和1-5有两个变量,则对比实验1-2和1-5,不能得出“增大浓度可使铜与硫酸反应”,故A不正确;
B、实验1-1铜片a附近溶液逐渐变蓝,生成新物质,则通电可促进一些化学反应的发生,故B正确;
C、实验证明铜与硫酸反应,不能证明铜与硫酸只能发生一种化学反应,故C不正确。故选AC。