题目内容
【题目】已知A、B、C、D是初中化学常见的四种不同类别的物质,相邻两种物质可以发生化学反应,分别生成甲、乙、丙、丁四种物质(部分生成物已略去),它们相互之间的关系如图所示。其中B是配制农药波尔多液的成分之一,其水溶液呈蓝色;C为应用最广泛的金属:丙为氯化物。
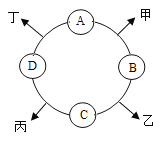
(1)B的化学式是_____,A所属的物质类别是_____。
(2)A与D反应的化学方程式为_____。
(3)B的溶液与C反应,溶液质量_____(填“增大”、“减小”或“不变”)
【答案】CuSO4 碱 Ca(OH)2+2HCl═CaCl2+2H2O 减小
【解析】
该题的突破口是B为杀菌剂波尔多液的成分之一,其溶液呈蓝色,则;C为应用最广泛的金属;丙为氯化物。B为波尔多液的主要成分,且其溶液呈蓝色可推出B为CuSO4,C为应用最广泛的金属,则C为Fe,由丙为氯化物可知D为酸,A、B、C、D是初中化学常见的四种不同类别的物质,则D为HCl,A为碱。结合化学方程式的书写和反应基本类型填空即可。
B为波尔多液的主要成分,且其溶液呈蓝色可推出B为CuSO4,C为应用最广泛的金属,则C为Fe,由丙为氯化物可知D为酸,A、B、C、D是初中化学常见的四种不同类别的物质,则D为HCl,A为碱。氢氧化钙和盐酸反应生成了氯化钙和水,化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;根据B和C反应方程式Fe+CuSO4=FeSO4+Cu↓可知溶液质量减小;
故答案是:
(1)CuSO4;碱(2)Ca(OH)2+2HCl═CaCl2+2H2O(3)减小。

【题目】一些金属易生锈,某小组同学设计如下实验,对金属锈蚀进行探究.
【实验一】取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验.
实验图示 |
|
|
|
|
|
生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
(1)通过上述实验可知,温度越高铁钉生锈速率越____(填“慢”或“快”);在_____(填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快.
【实验二】为探究铁锈的成分,用图1所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全).
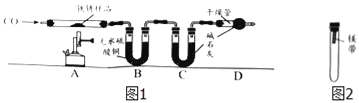
【查阅资料】无水硫酸铜能吸收水而变蓝,碱石灰既能吸收水也能吸收CO2.
(2)请指出图1所示实验装置的一个明显缺陷:___________________.
(3)加热前,先通入CO一段时间,目的是____________________.
(4)将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,由此推知铁锈中一定含有_____元素,从而推断出空气中的_______参加了铁生锈反应.
【实验记录】
铁锈样品的质量/g | 装置B的质量/g | 装置C的质量/g | |
反应前 | 23.2 | 232.4 | 198.2 |
反应后 | / | 239.6 | 211.4 |
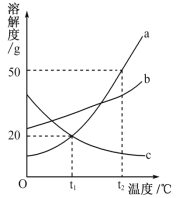
(5)根据上表数据推算,可确定铁锈的成分,用FexOynH2O表示,则n=_______;若缺少D装置,x:y的值_________(填“偏大”、“偏小”或“无影响”).
(6)欲通过实验探究镁带在空气中锈蚀的条件,用图2所示装置,试管内可选用的物质如下:
①O2 ②水 ③CO2 ④O2和CO2 ⑤CO2和水 ⑥O2和水 ⑦O2、CO2和水
至少需要选用___________(填数字序号),才能达到探究镁带锈蚀的条件.
(7)请写出镁带在空气中锈蚀,生成碱式碳酸镁[Mg3(OH)2(CO3)2]的化学方程式_______.