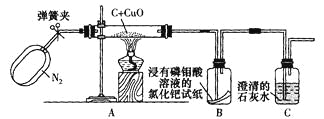
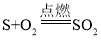题目内容
【题目】测定黄铜(铜锌合金)中铜的质量分数的过程如下,请回答下列问题:
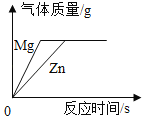
(1)小华同学取50 g黄铜,加入足量稀硫酸,共收集到1.0 g气体,计算黄铜中铜的质量分数______________(写出计算过程)。
(2)小婷同学另取50 g黄铜于烧杯中,将600 g稀硫酸分六次加入,测得加入稀硫酸的质量和烧杯中剩余物的质量如下表:
次数 | 一 | 二 | 三 | 四 | 五 | 六 |
加入稀硫酸的质量 / g | 100 | 100 | 100 | 100 | 100 | 100 |
烧杯中剩余物的质量 / g | 149.8 | a | 349.4 | 449.2 | 549.0 | 649.0 |
① 表中a = _____。
② 第六次实验后所得溶液的溶质是_____(写化学式)。
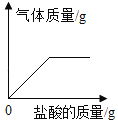
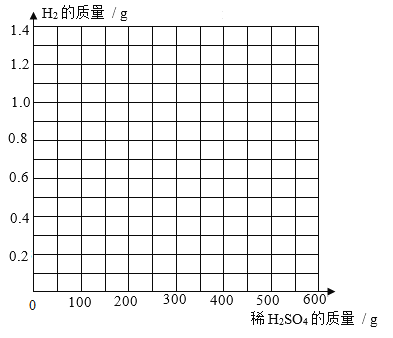
③ 画出加入0~600 g稀硫酸过程中生成H2质量的变化图,并标注必要的数值_____。
【答案】35% 249.6g H2SO4 、ZnSO4 
【解析】
(1)黄铜是铜和锌的合金,其中铜不与稀硫酸反应,锌与硫酸反应生成硫酸锌和氢气,取50 g黄铜,加入足量稀硫酸,共收集到1.0 g气体,设黄铜中锌的质量为x
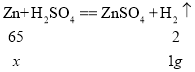
![]() x=32.5g
x=32.5g
黄铜中铜的质量分数:![]() ;
;
(2)①由表中数据可知,前四次加入硫酸后,每次生成0.2g氢气;表中a = 249.6g;
②由表中数据可知第五次试验中金属完全反应,第六次实验后硫酸剩余,所得溶液的溶质是H2SO4 、ZnSO4;
③加入0~600 g稀硫酸过程中生成H2质量的变化图, 。
。

【题目】根据教科书中的有关实验内容,填写以下实验报告
实验名称 | 实验操作 | 实验现象 | 实验结论或化学方程式 |
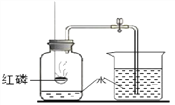
硫在氧气中燃烧 | 将硫粉点燃后,伸入盛有氧气的集气瓶 | 产生_____色火焰、放热、产生有刺激性气味的气体 |
|
碳在氧气中燃烧 | 将红热的木炭,伸入盛有氧气的集气瓶 | 木炭在氧气中比空气中燃烧的更旺,发出白光。 | 可 燃物燃烧的剧烈程度 与_____因素有关。 |
生石灰与水的反应 | 生石灰放人盛有水的试管中,用手触摸试管壁。 | 用手触摸试管壁时, 有_____感觉。 | 生石灰与水的反应属于放热反应。 |