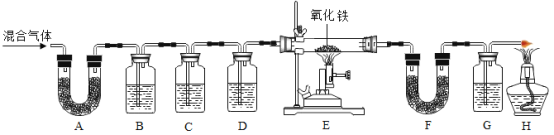
题目内容
【题目】如图所示为a、b、c三种物质的溶解度曲线。
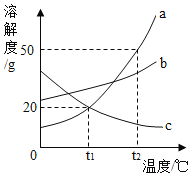
(1)t1℃时,将30ga物质加入到50g水中,而后升温到t2℃,此时该溶液的溶质和溶剂的质量比为__。
(2)t1℃时,24ga的饱和溶液稀释为10%,需要加入水__g。
(3)将t2℃时等质量的a、c的饱和溶液降温至t1℃此时两种溶液中溶质的质量分数大小关系为__。
【答案】1:2 16 a>c
【解析】
(1)t1℃时,a物质的溶解度是20g,所以将30ga物质加入到50g水中,而后升温到t2℃,溶解度为50g,所以此时该溶液的溶质和溶剂的质量比为25g:50g=1:2;
(2)t1℃时,24ga的饱和溶液稀释为10%,需要加入水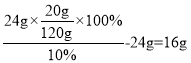 ;
;
(3)将t2℃时等质量的a、c的饱和溶液降温至t1℃,a物质的溶解度减小,c物质的溶解度增大,c物质应该按照t2℃时溶解度计算,所以此时两种溶液中溶质的质量分数大小关系为:a>c。

【题目】取20g碳酸钠和碳酸氢钠的固体混合物,加热至不再产生气体2NaHCO3![]() Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 |
仪器和浓硫酸的质量总和(g) | 150 | 150.9 | 151.8 | 151.8 |
(1)当完全反应后,生成水的质量为_____g。
(2)计算混合物中碳酸氢钠的质量分数________。(要求写出计算过程)
(3)将上述混合物完全分解后的固体溶解于186.2g 水中,待固体完全溶解后所得溶液中溶质的质量分数为_____。
【题目】中和反应是化学核心概念之一。某化学兴趣小组对中和反应展开了探究。
(实验目的)证明氢氧化钠溶液与盐酸发生化学反应。
(实验步骤)
步骤一:取一定量稀氢氧化钠溶液于烧杯中,滴加2滴酚酞试液,溶液呈红色。
步骤二:用仪器A吸取稀盐酸向烧杯中逐滴加入,边滴加边用玻璃棒搅拌,红色变浅直至消失。
步骤三:向溶液中继续滴加稀盐酸至溶液呈酸性,用玻璃棒蘸取其中溶液,在酒精灯上加热至蒸干,有白色固体产生。
(思考拓展)
(1)从下列仪器中选择步骤二中的“仪器A”,名称是_________。
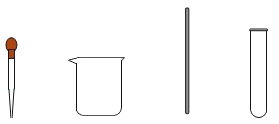
(2)兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。
查阅资料:(i)酚酞试液在不同的pH时变化情况如下:
pH | 0~8.2 | 8.2~10.0 | 10.0~14.0 |
颜色 | 无色 | 粉红色 | 红色 |
(ⅱ)氢氧化钠溶液的pH随浓度的降低而减小。
兴趣小组据此形成了对比实验方案以排除干扰,该对比实验方案是_____。
(3)为确认步骤三中的白色固体是氯化钠而不是氢氧化钠,进行如下实验:
步骤 | 现象 | 结论 | |
将白色固体溶于水形成溶液,均分成两等份 | 向其中一份滴加CuSO4溶液,振荡、静置 | ①无___色沉淀生成 | 白色固体不是NaOH。 |
向另一份滴加AgNO3溶液,振荡、静置 | 出现白色沉淀 | ②白色固体是NaCl,反应的化学方程式为___。 | |
(继续探究)
(4)如图是氢氧化钠与盐酸反应的微观示意图。从微观角度分析,氢氧化钠溶液和盐酸反应的实质是__________。
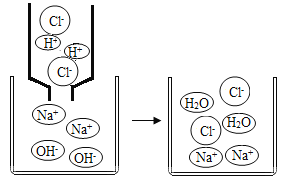
(5)兴趣小组认为上述实验对反应实质缺少直观的验证。
査阅资料:(ⅲ)变色硅胶为蓝色,吸水后呈红色。(ⅳ)变色硅胶与NaOH固体充分混合,无明显现象;变色硅胶与无水醋酸(CH3COOH)充分混合,无明显现象。
兴趣小组据此设计了如图实验,验证中和反应有水生成:将无水醋酸迅速倒入装有NaOH固体和变色硅胶的试管中,并用玻璃棒在试管中不断搅拌,观察到变色硅胶由蓝色逐渐变为红色,U型管内液面左低右高。

①U型管内液面左低右高说明该反应____热量(填写“放出”或“吸收”)。
②无水醋酸由CH3COO-和H+构成。变色硅胶由蓝色变成红色的原因是______(用化学方程式表示)。
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
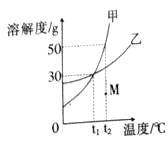
A.将甲、乙的饱和溶液从t2℃分别降温到t1℃,析出晶体的质量甲一定大于乙 |
B.t1℃时甲、乙的饱和溶液中溶质质量分数相等 |
C.t2℃时将40g甲溶于100g水中,形成饱和溶液 |
D.将M点的甲溶液变成饱和溶液常采取的方法是__________________________。 |