题目内容
【题目】金属锌与稀硫酸反应生成硫酸锌和氢气,化学课外小组的同学对“锌与硫酸反应快慢的影响因素”进行了探究。
(提出问题)锌与硫酸反应的快慢受哪些因素的影响呢?
(猜想与假设)a.可能与稀硫酸的浓度有关;b.可能与锌的形状有关。
(设计并实验)小组同学用不同质量分数的硫酸和不同形状的锌进行如下实验。
实验编号 | 稀硫酸的浓度(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)锌与稀硫酸反应的化学方程式为_____。
(2)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是_____。
(3)利用如图装置进行实验时,为了较准确的测量氢气的体积,在读取量气管中液面读数的过程中,应注意_____(填字母编号)。
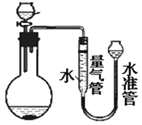
A.读数时视线与凹液面最低处相平。
B.保持水准管静止,待水准管中液面不再上升时再读数。
C.读数前应上下移动水准管,待两管液面相平再读数。
通过上述实验,你得出的结论是硫酸的质量分数越大,反应速率越快。锌与硫酸的接触面积越大,反应速率越快
(4)发生装置中留有氢气,是否会影响实验最终结果_____(填“是”或“否”)。
(5)下表是小组同学第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第4分钟 | 第3分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 9.6mL | 11.9mL | 7.6mL | 6.0mL |
解释第二分钟以后变化的原因_____。
【答案】Zn+H2SO4=ZnSO4+H2↑ ①③或②④ ABC 否 因为随着反应的进行,硫酸被消耗,硫酸溶液的浓度变小
【解析】
(1)根据锌和硫酸反应生成硫酸锌和氢气书写化学方程式;
(2)对比四个实验,利用控制变量法选择合适的对比组;
(3)根据读取量气管中液面读数的注意事项分析;
(4)根据同温同压下,不同气体混合后体积等于混合前各气体体积之和分析;
(5)根据表格数据看出反应由慢到快然后逐渐减慢分析。
(1)锌和硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;
(2)要比较不同质量分数的硫酸对反应快慢的影响,其中的锌的状态保持不变,选择不同质量分数的硫酸,看产生氢气的快慢,因此可以选择①③(都是锌粒)或②④(都是锌片);
(3)为了准确地测量氢气体积,在读取量气管中液面读数的过程中,应注意:读数时,要注意视线应于量气管凹液面的最低处保持水平;每次读数前应上下移动水准管,待两管液面相平再读数是为了防止水的压强造成的误差;故选ABC;
(4)根据“同温同压下,不同气体混合后体积等于混合前各气体体积之和”,留在试管内的氢气排出等体积的空气而使装置内气体体积总和不变,因此,此部分氢气并不影响对产生氢气的体积的测量;
(5)从表格数据看出反应由慢到快然后逐渐减慢,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案