题目内容
【题目】氯化钙(CaCl2)可用作干燥剂、混凝土防冻剂等。实验室用工业大理石(含有少量Al2O3、Fe2O3、SiO2等杂质)制备氯化钙的主要流程如下:
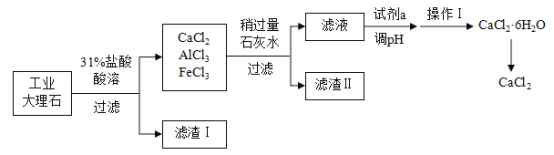
请回答下列问题:
(1)配制31%的稀盐酸730 g,需要36.5%的浓盐酸和 ___________g的水。
(2)滤渣I的成分为__________,滤渣II中含有Al(OH)3和___________。
(3)操作I采用的方法是:蒸发浓缩、___________、 过滤。
(4)加入试剂a的目的是中和稍过量的石灰水,该反应的化学方程式为_____。
【答案】110 SiO2 Fe(OH)3 冷却结晶 Ca(OH)2+2HCl═CaCl2+2H2O
【解析】
(1)溶液稀释前后,溶质质量不变,所以需要36.5%的浓盐酸的质量=![]() =620g;需要水的质量=730g-620g=110g;
=620g;需要水的质量=730g-620g=110g;
(2)金属氧化物会与酸反应生成盐和水,二氧化硅不会与酸反应,氯化铝和氢氧化钙反应生成氢氧化铝,氯化铁和氢氧化钙反应生成氢氧化铁沉淀,所以滤渣I的成分为SiO2,滤渣II中含有Al(OH)3和Fe(OH)3;
(3)操作I采用的方法是:蒸发浓缩、冷却结晶、过滤;
(4)氢氧化钙和盐酸反应生成氯化钙和水,化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目