题目内容
【题目】宏观辨识和微观探析是化学核心素养之一。根据下列微观示意图回答。
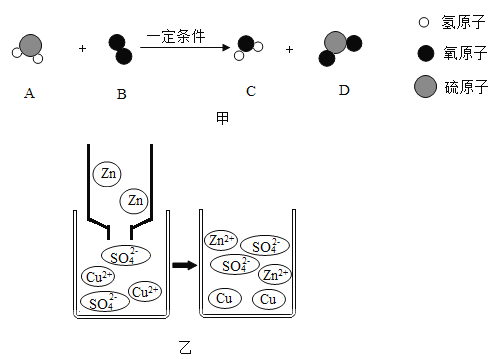
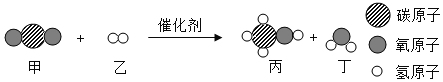
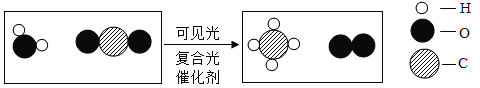
(1)如图甲所示,物质C由__构成(选填“分子”、“原子”或“离子”),反应的化学方程式为__。
(2)图乙是锌粒与硫酸铜溶液恰好完全反应的微观示意图,写出反应后溶液中所有粒子的符号___,反应属于____(填基本反应类型)。
【答案】分子 2H2S+3O2 2H2O+2SO2 H2O、Zn2+ 、SO42- 置换反应
2H2O+2SO2 H2O、Zn2+ 、SO42- 置换反应
【解析】
(1)由微观示意图可知A为硫化氢,B为氧气,C为水,D为二氧化硫,反应化学方程式为2H2S+3O2 2H2O+2SO2,水是由水分子构成的,故填:分子;2H2S+3O2
2H2O+2SO2,水是由水分子构成的,故填:分子;2H2S+3O2 2H2O+2SO2。
2H2O+2SO2。
(2)由图可知反应后溶液中粒子有H2O、Zn2+、SO42-,该反应为锌和硫酸铜反应生成了硫酸锌和铜,单质和化合物,反应生成了另一种单质和另一种化合物,属于置换反应,故填:H2O、Zn2+、SO42-;置换反应。

 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】日常生活中,每位同学都会接触到硬水。某校化学兴趣小组的同学在老师的带领下对硬水进行了一些探究和拓展实验。
[查阅资料]水的硬度是由水中溶解的可溶性钙和镁化合物引起的,硬水中溶解的钙和镁化合物可分为两类:钙、镁的碳酸氢盐:钙、镁的硫酸盐或氯化物,一般所说的水的硬度是由上述两类化合物引起的。
[实验探究一]小组同学对硬水中为什么含有碳酸氢钙非常感兴趣,于是再次学习九年级化学下册课本中的资料卡片:石笋和钟乳石的形成。知道了当石灰岩遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2
小组同学思考:若向碳酸钠溶液中通入一定量的二氧化碳,是否也能生成碳酸氢钠?于是他们对此开始实验探究(不考虑二氧化碳和碳酸作为溶质的情况)
[提出问题]所得溶液中溶质是什么?
[提出猜想]
猜想一:溶质为Na2CO3;
猜想二:______。
猜想三:溶质为Na2CO3和NaHCO3
[设计实验]
实验步骤 | 实验现象 | 实验结论 |
a.取所得溶液少许于试管中,向其中滴加过量的CaCl2溶液 | ______ | 猜想二不成立 |
b..______ | 有气泡冒出 | 猜想一不成立 |
通过实验,小组同学得出了正确结论。
[实验探究二]热水瓶用久后,瓶胆内壁常附着一层水垢, 老师说其成分主要是碳酸钙、氢氧化镁等。小组同学认为可使用醋酸(HAc)除去,请写出其中发生中和反应的化学方程式_____。
[实验探究三]小组同学还对稀盐酸和氢氧化钠溶液发生中和反应进行了如下探究:
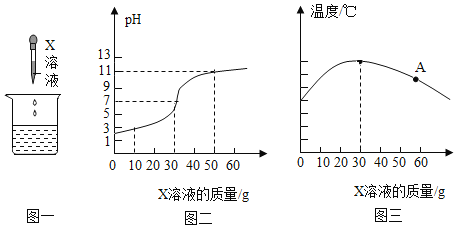
用pH传感器测得烧杯内溶液的pH变化图象(如图二),同时用温度传感器别得烧杯内温度变化图象(如图三),实验过程中保温良好,忽略热量散失。
Ⅰ.由图一、图二所示实验可知X溶液为______。
Ⅱ.请分析图三,能得到的结论是_______。
III.图三中A点对应溶液中的溶质有______。
【题目】不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ | 20 | 30 | 40 |
溶解度/g | 31.6 | 45.8 | 63.9 |
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3