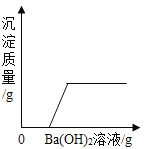
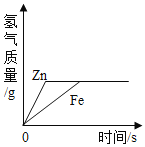
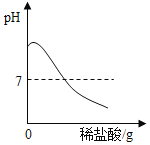
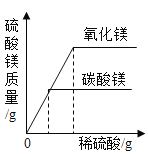
题目内容
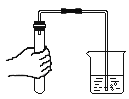
【题目】如图所示,某化学小组同学进行氢氧化钠与稀盐酸之间的中和反应实验。请根据实验示意图回答下列问题:
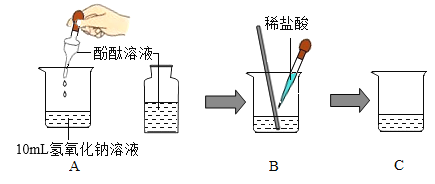
(1)操作中使用胶头滴管逐滴滴加,这样做的目的是_________。当观察到B中现象为__________,则氢氧化钠与稀盐酸刚好完全发生中和反应,该实验反应的化学方程式为_______________。
(2)在实验过程中,随着稀盐酸的不断滴入,B中的溶液温度计读数会逐渐升高,其原因是_____________。
(3)如果该小组同学在A中忘记在氢氧化钠溶液中滴加酚酞溶液,结果在C中再滴加酚酞溶液,观察到酚酞溶液不变色,为了进一步确定中和反应是否完全发生。取样加入金属锌,若有无色气泡,则C中溶液的溶质是_______(写名称)。
(4)除了用酸碱指示剂之外,还可用___________(填方法)检测中和反应是否发生。
(5)酸碱中和反应在工农业生产和日常生活中应用十分广泛。用化学方程式表示用熟石灰用于中和工厂排放稀硫酸的原理为______________。
【答案】防止稀盐酸过量 溶液由红色刚好变成无色 NaOH +HCl = NaCl + H2O 反应放热 氯化钠和氯化氢 pH试纸(合理即可) Ca(OH)2+ H2SO4= CaSO4+2H2O
【解析】
(1)在盐酸和氢氧化钠反应时,如果加入盐酸的速度稍快可能会使加入的盐酸过量,如使用胶头滴管逐滴加入盐酸,可以防止稀盐酸过量;酚酞试液在碱性溶液呈红色,在中性或酸性溶液中呈无色,当观察到B中现象为:溶液由红色刚好变成无色时,则氢氧化钠与稀盐酸刚好完全反应,该实验反应的化学方程式为NaOH +HCl == NaCl + H2O;
(2)在实验过程中,随着稀盐酸的不断滴入,B中的溶液温度计读数会逐渐升高,其原因是氢氧化钠和盐酸反应时放出大量的热;
(3)如果该小组同学在A中忘记在氢氧化钠溶液中滴加酚酞溶液,结果在C中再滴加酚酞溶液,观察到酚酞溶液不变色,可能是刚好完全反应,溶液中溶质是氯化钠;也可能是酸过量,溶液中溶质为氯化钠和氯化氢;可通过验证是否有酸来进一步确定中和反应是否完全发生。锌与盐酸反应能产生氢气,取样加入金属锌,若有无色气泡,则酸过量,则C中溶液的溶质是氯化钠和氯化氢;
(4)除了用酸碱指示剂之外,还可用pH试纸(合理即可)检测中和反应是否发生:反应前,氢氧化钠溶液的pH大于7,滴加盐酸后,如测定溶液的pH等于或小于7,则可证明氢氧化钠和盐酸反应了;
(5)熟石灰用于中和工厂排放稀硫酸的原理为氢氧化钙和硫酸反应生成硫酸钙和水,反应方程式为:Ca(OH)2+ H2SO4= CaSO4+2H2O。