题目内容
【题目】加热氯酸钾和二氧化锰的混合物可以制备氧气,该反应的化学方程式为______________。
但实验中发现有刺激性气味的气体生成。请你一起参与探究:
(提出问题)刺激性气味的气体是什么呢?
(猜想假设)
猜想一:臭氧(化学式为O3)。
猜想二:HCl。
猜想三:Cl2。
同学们认为不需要验证就可以判断___________是错误的,理由是______________。
(链接资料)
(1)![]() ,HClO 在水溶液中可解离出少量 H+、Cl-、ClO-、HClO 具有强氧化性和漂白性,可杀灭细菌、病毒,使有色物质褪色;
,HClO 在水溶液中可解离出少量 H+、Cl-、ClO-、HClO 具有强氧化性和漂白性,可杀灭细菌、病毒,使有色物质褪色;![]() ,AgCl 是一种白色沉淀。
,AgCl 是一种白色沉淀。
(2)臭氧在二氧化锰存在的情况下极易分解产生氧气。
(实验探究)
查阅资料后大家认为猜想一是错误的,理由为______________。他们进一步做了如下实验:取氯酸钾和二氧化锰的混合物放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管口,看到的现象是___________,再将湿润的蓝色石蕊试纸悬于试管口,试纸______________,最终证明猜想三正确。
(反思拓展)
自来水厂常用漂白粉杀菌消毒主要成分的化学式为Ca(ClO)2,在水中起杀菌消毒作用的离子是_____________。
【答案】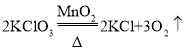 猜想二 不符合质量守恒定律 臭氧在二氧化锰存在下分解生成氧气 有白色沉淀生成 变红 ClO-
猜想二 不符合质量守恒定律 臭氧在二氧化锰存在下分解生成氧气 有白色沉淀生成 变红 ClO-
【解析】
氯酸钾在二氧化锰催化作用下,加热分解生成氧气和氯化钾,所以该反应的化学方程式为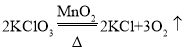 ;
;
故答案为: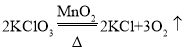 。
。
[猜想假设]
根据质量守恒定律可知,反应前后元素种类不发生变化,反应前不含有氢元素,所以生成物中不应出现氢元素的,所以猜想二错误;
故答案为:猜想二;不符合质量守恒定律。
[实验探究]
根据题目信息可知,臭氧在二氧化锰催化作用下容易分解生成氧气,氯酸钾需要二氧化锰作为催化剂进行反应,因此反应物中有二氧化锰存在,臭氧不易生成,所以猜想一错误;根据氯气与水反应的生成盐酸、次氯酸的性质,可知遇到硝酸银溶液时,盐酸会与硝酸银反应生成氯化银沉淀,因此可以观察到有白色沉淀生成;生成的盐酸、次氯酸都显酸性,所以遇到蓝色石蕊试纸后试纸变为红色,证明了酸的存在,从而说明了氯气的存在,猜想三正确;
故答案为:臭氧在二氧化锰存在下分解生成氧气;有白色沉淀生成;变红。
[反思拓展]
次氯酸钙溶于水形成钙离子和次氯酸根,钙离子不具有杀菌消毒的能力,结合题目信息,可知次氯酸根具有杀菌消毒的作用;
故答案为:ClO-。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案