题目内容
【题目】已知物质A~H为初中化学常见物质,请根据下列表述回答问题。
(1)已知A、B、C、D均含有两种元素,且物质B、D元素组成相同。固体A中加入液体B,能放出大量热。将固体C加入D的水溶液中,有气泡产生,充分反应后过滤,只得到液体B和固体C.
①A跟B反应的生成物可用于改良酸性土壤或用于建筑材料等,则A和B反应的化学方程式为_________.
②C的化学式为______________.
(2)固体E、F和物质G、H的水溶液中,任意一种固体与任意一种溶液混合均有气泡产生。E通过其他反应途径能生成F。
①若E为单质,E、F的化学式可能为______________ (写一组即可)。
②若E和F均含三种元素,E生成F的化学方程式为:_____________,固体E和二氧化硅在高温条件下可生成硅酸钠(Na2SiO3)和一种能产生温室效应的常见气体,该反应的化学方程式为:__________。
【答案】 CaO+H2O=Ca(OH)2 MnO2 Zn. Fe Ca(OH)2+Na2CO3=2NaOH+CaCO3↓ Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
【解析】本题是推断题。首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
(1)根据题目中的信息“固体C中加入液体D,有气泡产生,充分反应后过滤,只得到液体B和固体C”,C在反应前后都存在,C可能是反应中的催化剂,A、B、C、D均含有两种元素,B、D元素组成相同,固体C可是二氧化锰,液体D可能是过氧化氢溶液,液体B可能是水;固体A中加入液体B,能放出大量热,氧化钙与水反应生成氢氧化钙并放出大量的热,氢氧化钙可用于改良酸性土壤或用于建筑材料,固体A可能是氧化钙,将假设代入题中,假设成立。
①A跟B反应的是氧化钙与水反应生成氢氧化钙,发生反应的化学方程式为CaO+H2O=Ca(OH)2;
②C是二氧化锰,化学式是MnO2;
(2)根据题目中的信息“固体E、F和液体G、H四种物质中,任意一种固体与任意一种液体混合均有气泡产生。E通过其它反应能生成F”,“若E为单质”,“若E和F均含三种元素”,则E、F可能是活泼金属或碳酸盐,G、H可能是酸溶液。
①若E为单质,则E、F的化学式可能为Zn、Fe;
②若E和F均含三种元素,则E生成F可能为碳酸钠与氢氧化钙溶液的反应,则其化学方程式为Ca(OH)2+Na2CO3=2NaOH+CaCO3↓,固体E(碳酸钠)和二氧化硅在高温条件下可生成硅酸钠(Na2SiO3)和一种能产生温室效应的常见气体,则为二氧化碳,该反应的化学方程式为:Na2CO3+SiO2![]() 高温Na2SiO3+CO2↑。
高温Na2SiO3+CO2↑。

【题目】甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
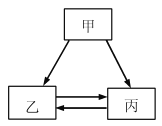
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Ca(OH)2 | CaCl2 | CaCO3 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D
【题目】碳酸钠和碳酸氢钠是生活中常见的盐,课外小组通过以下实验进行鉴别。
实验1
实验序号 实验操作 | 1-1碳酸钠 | 1-2碳酸氢钠 |
| 11.96 | 8.28 |
实验2
实验序号 实验操作 | 2-1碳酸钠溶液 | 2-2碳酸氢钠溶液 |
|
| |
实验3
实验序号 实验操作 | 3-1碳酸钠溶液 | 3-2碳酸氢钠溶液 |
| 不分解 | 2NaHCO3△ Na2CO3 +CO2 ↑+H2O |
回答下列问题:
(1)实验1中控制的变量是__________,实验1得出的结论是__________。
(2)实验2的目的是__________。
(3) ①实验3-2中观察到的现象是__________。
②完全分解8.4gNaHCO3能生成CO2__________g。
③要确定碳酸氢钠的分解产物,还需进行的实验是__________。
【题目】食品包装袋中常用脱氧剂。某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末。
【提出问题】该脱氧剂中的黑色、红色粉末各是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种。红色粉末可能含有氧化铁、铜粉中的一种或几种。
【进行实验】
实验编号 | 实验操作 | 实验现象 |
① | 取少量脱氧剂粉末于一支试管中,向其中加入足量稀硫酸 | 粉末几乎全部溶解,只有少量黑色粉末未溶解,有气泡产生,溶液变成黄色 |
② | 取实验①的残渣灼烧,将内壁蘸有澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
【得出结论】由实验①②可知,脱氧剂中黑色粉末肯定含_____________。脱氧剂中的红色粉末肯定不含_________,肯定含________;写出步骤①中溶液变黄这一现象对应的化学方程式____________。
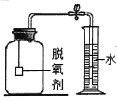
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如图所示。集气瓶的实际容积是150mL,量筒内盛1OOmL的水。当量筒内水面不再变化,且温度回复至室温时,读出水面在73mL刻度处。由上述实验数据可以算出,空气中氧气的体积分数是_________。本实验的测量结果与理论值不一致,原因可能是_________________。