题目内容
【题目】有一固体为铜和铁的混合物,为测定混合物中铜的质量分数,某学习小组取样品10g,加入足量的稀盐酸充分反应,产生的气体的质量与反应时间的关系图如图1.
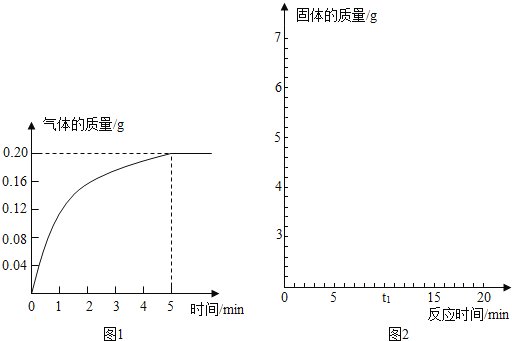
(1)生成气体的总质量为多少g.
(2)求该样品中铜的质量分数(写出计算过程)
(3)另一学习小组取样5克放于烧杯中,加入足量的硫酸铜溶液与之充分反应.试计算完全反应后烧杯中固体的质量为多少.请在坐标图2中画出烧杯中的固体的质量与反应时间的关系图.(假设该反应在时间t1时恰好完全反应)
【答案】(1)0.2 (2) 44%(过程见详解) (3)5.4g 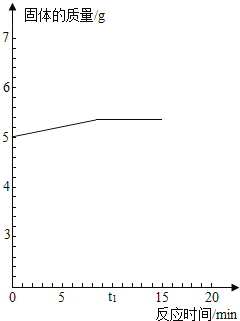
【解析】
(1)根据图1的图象直接读数;
(2)根据金属活动顺序表,铜和盐酸不反应,铁和盐酸反应生成氢气,进行计算解答;
(3)根据金属活动顺序表,铁可将硫酸铜溶液中的铜置换出来,进行计算作图。
(1)从图1可知,反应时间5分钟时,气体的质量不再增加,因为加入了足量的稀盐酸,所以可知此时混合物中的铁已经充分反应,生成氢气的质量为5分钟及以后对应的纵坐标,也就是0.2g;
(2)设混合物中铁的质量为x,根据铁与盐酸反应的化学方程式可得
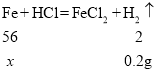
![]()
![]() =5.6g
=5.6g
可知混合物中铁的质量为5.6g,铁的质量分数为5.6g÷10g=56%,铜的质量分数为44%;
(3)由(2)可得,混合物中铁的质量分数为56%,那么5g混合物中含有铁的质量为2.8g,设铁与硫酸铜反应中置换得到的铜的质量是y,根据铁与硫酸铜反应的化学方程式可得:
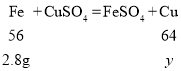
![]()
y=3.2g
可知置换出3.2g铜,因加入了足量的硫酸铜溶液,烧杯中固体的质量为置换出铜的质量与混合物中铜的质量,故烧杯中固体的质量为3.2g+2.2g=5.4g;
在绘制关系图时,烧杯中固体质量在反应开始时质量为5g,所以横轴坐标为0时,纵轴坐标为5;在t1时恰好完全反应,此刻烧杯中固体的质量为5.4g,所以横轴坐标为t1时,,纵轴坐标为5.4;之后因为铁被完全消耗,烧杯中固体的质量在t1时间后一直保持在5.4g,所以横坐标为t1后的各点纵坐标为5.4;连接各点即可做出关系图。