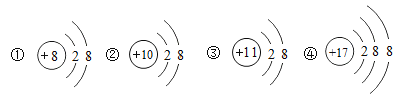题目内容
【题目】硫酸镁溶液可以和氢氧化钠溶液反应,该反应前后溶液中主要存在的离子(每种图形代表不同离子)如图所示。
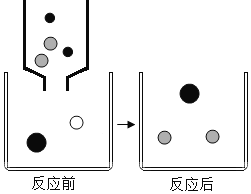
(1)该实验过程中可以观察到的现象是______________
(2)图示中“![]() ”的离子符号是___________,滴管中盛放的是_________溶液(填化学式)。
”的离子符号是___________,滴管中盛放的是_________溶液(填化学式)。
(3)氨水(NH3H2O)也能和硫酸镁反应,原因是氨水和氢氧化钠溶液中均含有一种相同离子,该离子是___________。(填离子符号)
(4)某同学用镁粉溶于100g稀硫酸反应得到的溶液和溶质质量分数为20%的氢氧化钠溶液恰好充分反应,沉淀经过滤、洗涤、干燥后称量,测得质量为5.8g。写出生成沉淀的化学方程式并计算消耗氢氧化钠溶液的质量(列式计算)。________
【答案】有白色沉淀生成 Mg2+ NaOH OH- 2NaOH+MgSO4=Mg(OH)2↓+Na2SO4,消耗氢氧化钠溶液的质量为40g
【解析】
氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠。
根据图像分析可知,反应后是硫酸钠溶液,硫酸钠在水溶液中电离出2个钠离子和1个硫酸根离子,则![]() 是硫酸根离子,
是硫酸根离子,![]() 是钠离子。则
是钠离子。则![]() 是氢氧根离子,
是氢氧根离子,![]() 是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。
是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。
(1)氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,观察到的现象是溶液中有白色沉淀生成。故答案为:有白色沉淀生成;
(2)通过分析可知,图中![]() 表示的是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。故答案为:Mg2+、NaOH;
表示的是镁离子。该实验是将氢氧化钠溶液滴入硫酸镁溶液中。故答案为:Mg2+、NaOH;
(3)氨水属于碱,和氢氧化钠在水溶液中均能电离出氢氧根离子。故答案为:OH-;
(4)设消耗氢氧化钠的质量为x。
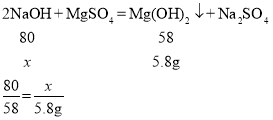
解得x=8g
则消耗氢氧化钠溶液的质量为:8g÷20%=40g。

【题目】如表为氯化钠和氯化铵在不同温度时的溶解度,请回答下列问题。
温度/°C | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 49.6 |
NaC1溶解度/g | 35.4 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(1)由表中数据可知,溶解度随温度变化较大的物质是_____。
(2)20°C时,100g水最多能溶解NaC1_____g;
(3)向烧杯中加入100g水和49.0g氯化铵配成50°C的溶液,此时溶液为_____溶液(填“饱和”或“不饱和”);再冷却到20°C,烧杯中析出固体的质量为_____g;另外多角度看物质,有助于加深对物质的认识。Na2CO3是一种常见的盐,请回答:
(4)Na2CO3溶液显碱性,其pH_____7(填“<”、“>”或“=”);
(5)Na2CO3可看成是碱和氧化物反应的产物,写出反应的化学方程式_____。
(6)Na2CO3作为反应物之一,写出一个符合![]() 形式的化学方程式_____。
形式的化学方程式_____。