题目内容
【题目】小苏打(碳酸氢钠)在日常生活中有广泛的用途,工业上制取小苏打有多种方法,其中有一种是气相固碳法,其利用的原理是:Na2CO3+H2O+CO2=2NaHCO3资料1:NaHCO3+NaOH=Na2CO3+H2O
资料2:碳酸钠和碳酸氢钠的溶解度表(一个标准大气压下)(部分)
温度/℃ | 0 | 15 | 20 | 30 | 40 | 50 | 60 |
碳酸氢钠溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 | 12.7 | 14.45 | 16.4 |
碳酸钠溶解度/g | 7.7 | 13.25 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
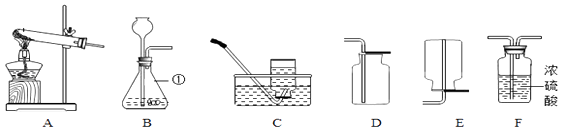
学校实验小组验证反应原理,在室温为15℃时,同学们将10g氢氧化钠固体完全溶解溶于80g水中(见图1烧杯),而后匀速的通入二氧化碳气体.同时用传感器测定溶液的pH变化,同时用数据采集器记录并绘制图象如图2所示.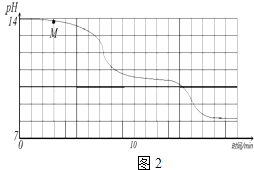
(1)图1所示实验中,用“分液漏斗”而不用“长颈漏斗”其原因是; 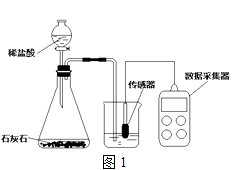
(2)通过图象分析,小苏打溶液是显(填“酸性”、“中性”或“碱性”),图象中M点处发生的主要化学反应方程式为;
(3)为了确定M处溶液的成分,同学们进行如下实验:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
① | 加入 | 有白色沉淀 | 有物质 |
② | 滴入 |
(4)实验过程中,同学们发现18min后溶液的pH基本不再变化,则此时烧杯中就可观察到的现象有 .
【答案】
(1)控制稀盐酸滴入速率,从而控制二氧化碳生成速率
(2)碱性;2NaOH+CO2=Na2CO3+H2O
(3)足量氯化钙溶液;碳酸钠和氢氧化钠;酚酞试液;酚酞试液变红色
(4)出现白色不溶物
【解析】解:(1)图1所示实验中,用“分液漏斗”而不用“长颈漏斗”其原因是控制稀盐酸滴入速率,从而控制二氧化碳生成速率. 故填:控制稀盐酸滴入速率,从而控制二氧化碳生成速率.(2)通过图象分析可知,随着反应进行,溶液pH始终等于7,说明小苏打溶液显碱性;
图象中M点处发生的主要化学反应是:二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O.
故填:碱性;2NaOH+CO2=Na2CO3+H2O.(3)为了确定M处溶液的成分,进行如下实验:①取M处少量溶液于试管中,加入足量氯化钙溶液,产生白色沉淀,说明溶液中含有碳酸钠;②静置后向试管中滴加适量的酚酞试液,酚酞试液变红色,说明溶液中含有氢氧化钠,实验过程如下表所示:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
① | 加入足量氯化钙溶液 | 有白色沉淀 | 有碳酸钠和氢氧化钠 |
② | 滴入酚酞试液 | 酚酞试液变红色 |
;(4)实验过程中,发现18min后溶液的pH基本不再变化,说明反应生成的碳酸氢钠溶液已经达到饱和状态,碳酸氢钠不能继续溶解,则此时烧杯中就可观察到的现象有出现白色不溶物.
故填:出现白色不溶物.
【考点精析】根据题目的已知条件,利用书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握注意:a、配平 b、条件 c、箭号.

【题目】A在B中充分燃烧生成C和D,A、B、C、D的微观示意图如下所示
物质 | A | B | C | D |
|
分子示意图 | | | | |
看图回答:
(1)属于氧化物的是(填字母序号)
(2)A中氮、氢原子数之比为 , 氮、氢元素质量之比为 .
(3)A在B中充分燃烧的化学方程式为 , 基本反应类型为 .