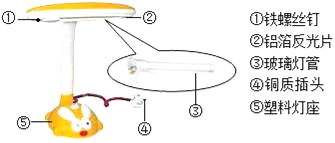
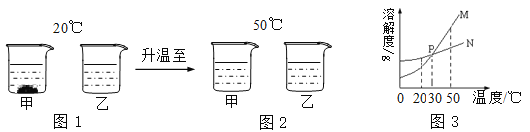
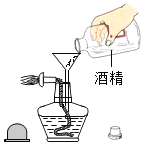
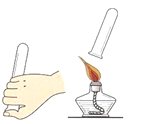
题目内容
【题目】氯化钙是多用途的干燥剂和建筑防冻剂。实验室里用石灰石和盐酸制备二氧化碳的含酸废液(含有MgCl2、FeCl3等)通过以下途径制得无水氯化钙。
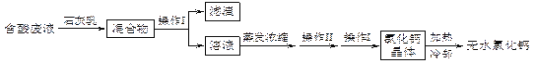
(1)操作I的名称为_____,操作II的名称为______。滤渣的化学成分有____________________。
(2)石灰乳的作用是①_____________________,②_________________________,写出其中1个反应的化学方程式____________________________________。
【答案】过滤 降温结晶 Mg(OH)2、 Fe (OH)3 中和多余的盐酸 除去Mg2+和Fe3+ 2HCl + Ca(OH)2 = CaCl2 + 2H2O 或Ca(OH)2 + MgCl2= Mg(OH)2↓+ CaCl2或3Ca(OH)2 +2 FeCl3=2Fe= (OH)3↓+ 3CaCl2 。
【解析】
(1)混合物中有易溶于水的、难溶于水的物质,所以操作 I的名称是过滤;蒸发浓缩过程中溶液温度较高,降低温度使溶质从溶液中析出,操作II的名称是冷却结晶或结晶;根据流程中发生的反应: 2 FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2,MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,Mg(OH)2、Fe(OH)3都难溶于水,所以滤渣的化学成分有Mg(OH)2、Fe(OH)3;
(2)石灰乳参加的反应有:2HCl + Ca(OH)2 = CaCl2 + 2H2O 2 FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2,MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,所以石灰乳的作用是:①中和废液中的酸,②使废液中的镁、铁完全沉淀,除去Mg2+和Fe3+;流程中的反应化学方程式有:2HCl + Ca(OH)2 = CaCl2 + 2H2O 或Ca(OH)2 + MgCl2= Mg(OH)2↓+ CaCl2
或3Ca(OH)2 +2 FeCl3=2Fe= (OH)3↓+ 3CaCl2。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】某化学兴趣小组向澄清石灰水中滴加酚酞溶液,然后将其倒入装有二氧化碳的塑料瓶中,振荡,惊奇地发现:酚酞先变红后又褪色,澄清石灰水先变浑浊后又变澄清。请你与他们一同探究。
(1)酚酞溶液先变红的原因是_____,后又褪色的原因是_____(用化学方程式表示)。
(2)(提出问题)什么物质使浑浊的石灰水再次变澄清?
(猜想假设)猜想1:_____;猜想2:酚酞溶液;猜想3:二氧化碳气体。
(实验验证)兴趣小组在试管中加入2mL澄清石灰水,通入二氧化碳气体,浑浊后,立即停止;向浑浊的石灰水中滴加酚酞溶液,振荡,观察到的现象为_____,故猜想2不正确。
(3)为了验证猜想3正确,请你设计实验方案并写出预计的实验现象。
实验步骤 | 实验现象 |
_____ | _____ |
(4)(反思评价)兴趣小组的同学利用pH传感器测定整个反应过程中溶液酸碱度的变化。pH变化曲线如图所示。
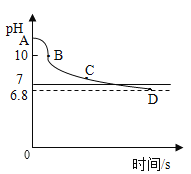
线段 | AB | BC | CD |
酚酞溶液 | 红色液体 | 红色消失 | 无色透明液体 |
澄清石灰水 | 液体浑浊 | 液体由浑浊变澄清 | 无色透明液体 |
经查阅资料可知,BC段可能反应生成了Ca(HCO3)2.请回答:
①实验室在使用酚酞溶液时应注意:_____。
②请用简单的实验方法证明可能生成了Ca(HCO3)2:_____。
③请写出BC段发生反应的化学方程式:_____