��Ŀ����
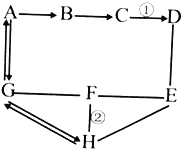
����Ŀ��ͼʾ��AһF�dz��л�ѧ���������ʣ�����A��һ�����Σ�C��DΪ�����A��B��C��D��E�ж�������Ԫ�أ�������C�Ĺ����׳ơ��ɱ�����ͼ�С�������ʾ��������������֮����Է�����Ӧ����������ʾ���ʼ��������Ӧ��ת����ϵ(���ַ�Ӧ������P��Ӧ��������ȥ)�������������
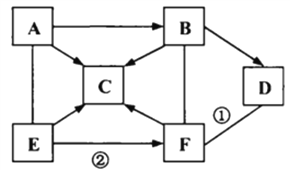
��1������C�Ļ�ѧʽ__________________��
��2����Ӧ�ٵĻ�����Ӧ������__________________��
��3����Ӧ�ڵĻ�ѧ����ʽ___________________________________��
���𰸡� CO2�� ���ֽⷴӦ�� BaCl2+H2SO4=BaSO4��+2HCl��
�������������ǿ�ͼ���ƶ��⡣���Ƚ������������������Ƴ���Ȼ�����Ƴ������ʺ����е�ת����ϵ�Ƶ�ʣ������ʣ�����Ƴ��ĸ������ʴ���ת����ϵ�н�����֤������
����C�Ĺ����׳ơ��ɱ�����C�Ƕ�����̼��A��һ�����Σ�A�����ɶ�����̼��A������̼������̼����������B��B�����ɶ�����̼��̼�������������Ʒ�Ӧ����̼��ƺ��������ƣ�̼��������ᷴӦ�����Ȼ�����ˮ�Ͷ�����̼��B������̼�����̼��������E��Ӧ��E�����ɶ�����̼��E�к�����Ԫ�أ�̼���������ᷴӦ���������ơ�ˮ�Ͷ�����̼��E����������������������F��F�����ɶ�����̼���������Ȼ�����Ӧ�������ᱵ�����ᣬ̼��������ᷴӦ�����Ȼ�����ˮ�Ͷ�����̼��F���������ᣬ��������̼��Ʒ�Ӧ��D�������̼���������D���������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ��̼��Ƹ��·ֽ����������ƺͶ�����̼��D������������������������ͼ����������������
��1������C�Ƕ�����̼����ѧʽ��CO2��
��2����Ӧ�����������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ���÷�Ӧ�������ֻ����ﻥ�ཻ���ɷ֣������������ֻ�����ķ�Ӧ��������Ӧ�����Ǹ��ֽⷴӦ��
��3����Ӧ�����������Ȼ�����Ӧ�������ᱵ���������÷�Ӧ�Ļ�ѧ����ʽ��BaCl2+H2SO4=BaSO4��+2HCl��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����úֱ����ȼ����������д���������ú�е�������SO2������ɴ�����Ⱦ��
(1)�����Ϸ�����һ��ú����8%��ij�������糧ȼ��100t����ú������ȼ��ʱú�е���ȫ��ת��ΪSO2�������SO2��������________?
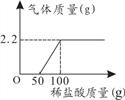
(2)����ú�л����ĩ״��ʯ��ʯ����ȼ�ղ�����SO2����CaCO3��Ӧ����CaSO3����¯�������ٴ�����Ⱦ��ȡ50g��¯��(��24%CaSO3)��μ���20%�����ᣬ����ͼ�����л�����Ӧ������ͼ(������Ϊ�ε����������趨�������ʣ�����������б�Ҫ������)��
 ________________
________________
[��֪]����¯���Ѳ���ʯ��ʯ��¯�������ɷֲ������ᷴӦ��
��CaSO3�����ᷴӦ������CaCO3
(3)��ȼ�պ����������ʯ�ҽ�Ҳ������SO2����CaSO3������һ��Ԫ�ֱ�������ԭ������ȥSO2������������±�:
���� | ���� | ��Է������� | ���� | �۸�(Ԫ/t) | ��SO2����(t) |
A | ʯ��ʯ | 100 | 90% | 200 | 14.4 |
B | ��ʯ�� | 74 | 94% | 500 | 14.6 |
����B�ȷ���A��SO2�����Դ��ҹ�ҵ�϶������÷���B����ԭ��ֱ���:_________��
����Ŀ����֪�Ȼ��ء�������ڲ�ͬ�¶�ʱ���ܽ�����±���
�¶�/�� | 0 | 20 | 40 | 60 | |
�ܽ��/g | �Ȼ��� | 27.6 | 34.0 | 40.0 | 45.5 |
����� | 13.3 | 31.6 | 63.9 | 110.0 | |
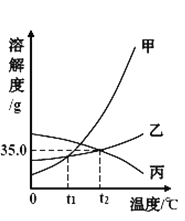
�����ϱ����ݺ��ܽ�������жϣ�����˵���������
A. �ܱ�ʾ����غ��Ȼ��ص��ܽ�����߷ֱ��Ǽ���
B. t1��ʱ���Ȼ��غ�����ص��ܽ����ȣ��� 34.0 g �� 35.0 g ֮��
C. t2��ʱ�����ӽ����͵ı����ʵ���Һ�����¶ȣ���ʹ���ɱ�����Һ
D. �Ȼ����л�������������أ��ɲ��ý��½ᾧ�ķ����ᴿ