题目内容
【题目】工业生产常用“苛化法”制取氢氧化钠其原料为碳酸钠、石灰乳[由Ca(OH)2和水组成的混合物],大致流程如下。
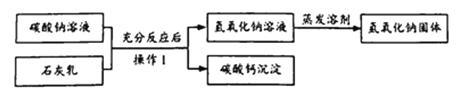
科学兴趣小组模拟上述流程,在实验室中制备氢氧化钠。
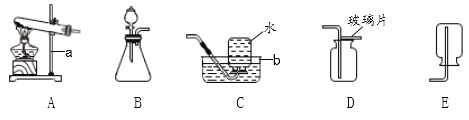
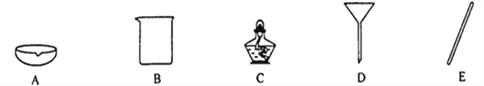
(1)实验室进行“操作1”时,需要用到下列器材中的_______(可多选).
(2)制备氢氧化钠的化学方程式为,Na2CO3+Ca(OH)2=2NaOH+CaCO3↓.将53克溶质质量分数为20%的碳酸钠溶液与17克石灰乳混合,若二者恰好完全反应出计算所得氢氧化钠溶液的溶质质量分数_______。(写出计算过程,计算结果精确到0.1%)
【答案】 BDE 13.3%
【解析】根据所学知识和题中信息知,(1)实验室“操作1”是过滤,需要用到下列器材中的烧杯,漏斗和玻璃棒。故选BDE。
(2) 解∶设反应所得氢氧化钠质量为x,生成碳酸钙质量为y
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
106 80 100
53g x y
![]() =
=![]() ,x=40g。
,x=40g。![]() =
=![]() ,y=10g。
,y=10g。
所得氢氧化钠溶液的溶质质量分数是![]() ×100%=13.3%。
×100%=13.3%。
点睛∶灵活应用质量守恒定律,正确书写化学方程式是顺利完成本题的重要保证。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目