题目内容
【题目】某铁矿粉,主要成分为铁的氧化物(FexOy),一学生利用实验作进一步分析,过程及数据如下.(注:铁矿粉中杂质不参与下列过程中的反应)
ⅰ.取29g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重17.6g
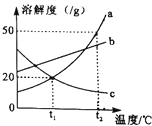
ⅱ.将上述加热后的固体取出后,再向固体逐滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如图: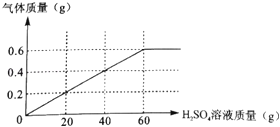
通过计算回答下列问题:
(1)过程ⅰ中生成气体的质量g,过程ⅱ中固体充分反应后,产生气体的质量为g.
(2)所用稀硫酸溶液的溶质质量分数为 .
(3)29g铁矿粉所含铁的氧化物中,铁元素的质量为g,氧元素的质量为g.
(4)该铁的氧化物化学式中,x、y的最简整数比x:y= .
【答案】
(1)17.6;0.6
(2)49%
(3)16.8;6.4
(4)3:4
【解析】(1)CO具有还原性,能与铁的氧化物反应而使铁的氧化物还原成铁,同时放出二氧化碳,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重17.6g,增重为反应生成二氧化碳的质量,过程ⅰ中生成气体的质量为17.6g;生成的铁与硫酸反应生成硫酸亚铁和氢气,过程ⅱ中固体充分反应后,产生气体的质量为0.6g;
(2)设所用稀硫酸溶液的溶质质量为x,铁的质量为y
Fe+H2SO4═FeSO4+H2↑
56 98 2
y x 0.6g![]()
y=16.8g![]()
x=29.4g
所用稀硫酸溶液的溶质质量分数为: ![]() 100%=49%;
100%=49%;
(3)FexOy+yCO ![]() xFe+yCO2;
xFe+yCO2;
56x 44y
16.8g 17.6g![]()
![]() =
=![]() ;
;
(4)则:该铁的氧化物化学式中,x、y的最简整数比x:y=3:4,
29g铁矿粉所含铁的氧化物中,铁元素的质量为16.8g× ![]() =6.4g.
=6.4g.
答案:(1)17.6;0.6;(2)49%;(3)16.8;6.4;(4)3:4
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

 阅读快车系列答案
阅读快车系列答案【题目】常喝牛奶可补充人们对钙的需求,牛奶中营养成分的含量如表所示.
(1)牛奶中的钙主要以磷酸钙[Ca3(PO4)2]的形式存在,磷酸钙的相对分子质量为 , 其中Ca、P、O的质量比为 .
(2)请列式计算:
①碳酸钙中钙的质量分数.(结果精确至0.1%)
②中学生每天需从牛奶中补充约550mg的钙,若一盒牛奶为250mL,则理论上每天应喝几盒牛奶.
牛奶营养成分表 | |
项目 | 每100mL |
能量 | 272kJ |
蛋白质 | 3.2g |
脂肪 | 3.8g |
碳水化合物 | 4.5g |
钠 | 60mg |
钙 | 110mg |
【题目】醋是中国传统的调味品,如图是市场上售卖的某一品牌白醋,标签说明:除了3~5%醋酸(CH3COOH)和水之外不含或极少含其他成分,请回答相应问题.![]()
(1)白醋是(填“纯净物”或“混合物”),醋酸分子中氢氧原子个数比为 .
(2)酿醋原理是在醋酸菌作用下乙醇(CH3CH2OH)与氧气反应,除生成醋酸外,还有另一产物,请写出该反应的化学方程式 .
(3)已知:HNO3是一元酸,H2SO4是二元酸,某同学对白醋性质进行如下探究.
实验操作 | 实验现象 | 实验结论与解释 |
①向白醋中滴入 | 观察到溶液变红 | 白醋显酸性 |
②向镁粉中滴加白醋直至过量 | 白醋能与活泼金属反应 | |
③100g含醋酸3%的白醋恰好与20g10%的NaOH溶液中和 | / | 醋酸为元酸(填一、二等数字) |
④将白醋滴加到碳酸钙表面 | 有少量气泡产生 | 反应的化学方程式是 |