题目内容
【题目】用“侯氏制碱法”制得的纯碱常含有少量的氯化钠。为了测定某纯碱样品的纯度,某化学兴趣小组的同学取了12g样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗稀盐酸73g,烧杯中没有残留不溶物,称得反应后溶液的质量为80.6g。计算:
(1)生成二氧化碳多少克?
(2)该样品的纯度是多少?
(3)实验结束后,兴趣小组做了反思,认为该实验除了以上方法外,还可以依据不同的原理来设计,请简述他们可能想到的一种方法。
【答案】4.4g;88.3%;取12g样品加入足量的水溶解后加入氯化钙溶液至沉淀不再产生,过滤、洗涤、干燥后称取固体的质量,进行计算(其他合理即可)
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算该样品的纯度。
解:(1)根据质量守恒定律可得,生成的二氧化碳的质量为12g+73g﹣80.6g=4.4g;
(2)设该样品的纯度为x,
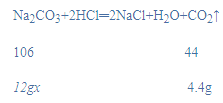
![]()
x≈88.3%;
(3)可以采取沉淀法:取12g样品加入足量的水溶解后加入氯化钙溶液至沉淀不再产生,过滤、洗涤、干燥后称取固体的质量,进行计算;
答:(1)生成二氧化碳4.4g;
(2)该样品的纯度是88.3%;
(3)取12g样品加入足量的水溶解后加入氯化钙溶液至沉淀不再产生,过滤、洗涤、干燥后称取固体的质量,进行计算。

练习册系列答案
相关题目