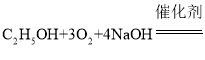题目内容
【题目】某碳酸钙粉末中,只含有一种杂质:氧化钙或氢氧化钙。为确定其中的杂质成分,取样后进行如下图所示的实验:
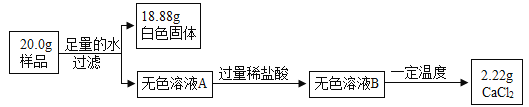
(1)样品中含有碳酸钙的质量为_____g;
(2)加入过量的稀盐酸时,发生的反应可用化学方程式表示为_____;
(3)下列实验操作中,能够判断加入的稀盐酸是否过量的是_____;
A 取无色溶液A,滴加石蕊溶液
B 取无色溶液B,放入一根铁钉
C 取无色溶液B,滴加硝酸银溶液
(4)通过计算确定该碳酸钙粉末中的杂质是_____。
【答案】18.88 ![]() AB CaO
AB CaO
【解析】
(1)某碳酸钙粉末中,只含有一种杂质:氧化钙或氢氧化钙,氧化钙和水反应生成氢氧化钙,加入足量水后,氢氧化钙能完全溶解,剩余固体为碳酸钙,样品中含有碳酸钙的质量为18.88g;
(2)滤液中的溶质为氢氧化钙,加入过量的稀盐酸时,发生的反应为氢氧化钙和盐酸反应生成氯化钙和水,化学方程式为![]() ;
;
(3))A.由于酸能使石蕊溶液变红,所以取无色溶液A,滴加石蕊溶液,能判断加入的酸是否过量,故A正确;
B.由于铁能与稀盐酸反应生成氯化亚铁(溶液为浅绿色)、产生氢气(出现气泡),取无色溶液B,放入一根铁钉能判断加入的酸是否过量,故B正确;
C.由于溶液中含有氯化钙,所以取无色溶液B,滴加硝酸银溶液,氯化钙和可能存在的盐酸都能和硝酸银反应产生白色沉淀,不能判断稀盐酸是否过量,故C错误;
故选AB;
(4)由题意可知,杂质的质量为:20g-18.88g=1.12g,据质量守恒定律可知,反应前后元素的种类、质量不变,所以,杂质中钙元素的质量=氯化钙中钙元素的质量,则:
钙元素的质量为:![]() ;
;
若是氧化钙,则氧化钙的质量为:![]() ,
,
若是氢氧化钙,则氢氧化钙的质量为:![]() ,
,
通过计算确定该碳酸钙粉末中的杂质是氧化钙。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
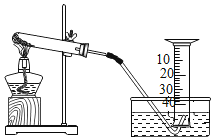
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是___________________
(2)表中所列3种催化剂的催化效果最佳的是______________
(3)写出KClO3分解的化学方程式:_________________________
(4)由实验1和实验4可知,KCl____(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:_____________
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内____________
【题目】为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20g固体混合物置于烧杯中,将100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
次序 | ① | ② | ③ | ④ |
加入稀硫酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 16 | a | 10 | 10 |
回答列问题:
(1)原固体混合物中,氧化铜的质量分数为_____。
(2)上表中,a的值为_____,实验③所得溶液中的溶质是_____(填化学式)。
(3)该实验所用稀硫酸中溶质的质量分数为____。(写出计算过程,结果精确到0.1%)