题目内容
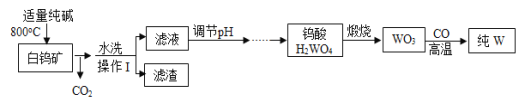
【题目】白钨矿的主要成分是CaWO4,工业上用白钨矿生产钨的流程如图所示:
(查阅资料)
CaWO4与纯碱发生反应的化学方程式是CaWO4+Na2CO3═Na2WO4+CaO+CO2↑。
(1)反应前需要将白钨矿进行粉碎,其目的是_____;
(2)水洗后进行的分离操作中,所用的玻璃仪器有烧杯、_____和玻璃棒,其中玻璃棒的作用是_____;
(3)上述滤液的成分中含有氢氧化钙,写出生成该物质的反应的化学方程式:_____;
(4)三氧化钨与氢气反应时,表现出还原性的物质是_____写出金属钨的一种用途:_____。
【答案】增大反应物的接触面积,提高反应速率,提高转化率 漏斗 引流 CaO+H2O=Ca(OH)2 氢气 制作灯丝等
【解析】
(1)由于反应物之间接触面积越大,反应越快,转化率也越高,所以反应前需要将白钨矿进行粉碎,其目的是增大反应物的接触面积,提高反应速率,提高转化率;
(2)水洗后进行的分离操作中,所用的玻璃仪器有烧杯、漏斗和玻璃棒,其中玻璃棒的作用是引流;
(3)根据信息“CaWO4与纯碱发生反应的化学方程式是CaWO4+Na2CO3═Na2 WO4 +CaO+CO2↑”可知,反应生成了氧化钙,上述滤液的成分中含有的氢氧化钙是氧化钙和水反应生成,对应的化学方程式为:CaO+H2O=Ca(OH)2;
(4)三氧化钨与氢气反应时,氢气得氧,表现出还原性。由于金属钨熔点很高,所以金属钨的一种用途:制作灯丝等。

 阅读快车系列答案
阅读快车系列答案【题目】在过氧化氢溶液制取氧气的实验中,可用FeCl3溶液作为催化剂,为进一步探究FeCl3溶液中哪种粒子能起催化作用,某兴趣小组作了以下探究:
(提出问题)FeCl3溶液中哪种粒子能起催化作用?
(查阅资料)氯化钠溶液,氯化钾溶液中含有Cl-;氯化铁溶液,硝酸铁和硫酸铁溶液中都含有Fe3+;氢氧化铁不溶于水;Fe3+和Fe2+化学性质不同。
(猜想假设)猜想一:Fe3+起催化作用;猜想二:______起催化作用;猜想三:H2O起催化作用
(实验探究)小组同学经过讨论与交流首先排除了猜想三,请设计实验验证猜想一。
实验步骤 | 现象 | 结论 |
____ | 几乎没有气泡放出 | 猜想一正确论 |
______ | 迅速产生大量气泡 |
(反思交流)如果要确定FeCl3是催化剂,还必须通过实验验证___。请写出过氧化氢制取氧气的化学方程式___。
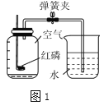
(继续探究)小组同学通过查阅资料还知道,Cu2+也能作为过氧化氢分解制取氧气的催化剂,为比较Fe3+和Cu2+对过氧化氢分解的催化效果,小组同学又进行了下列探究:
(1)如图,可通过观察____来定性比较两者的催化效果。
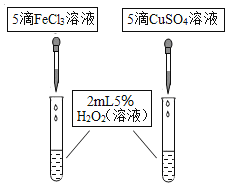
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____。能否改为FeSO4?___,你认为除此以外还可以作何修改?___。
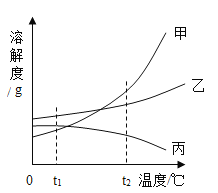
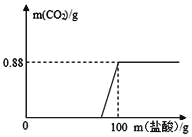
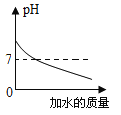
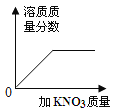
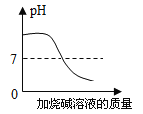
【题目】下列图像表述的化学事实与实际相符的是
A | B | C | D | |
图象 |
|
|
|
|
实验或事实 | 向pH=12的Ca(OH)2溶液中不断加水稀释 | 20C时,向一杯不饱和的KNO3溶液中逐步加入KNO3晶体 | 向稀盐酸中滴加过量的烧碱溶液 | 将一定质量的MnO2和KClO混合加热 |
A. AB. BC. CD. D