题目内容
【题目】(9分)化学是研究物质组成、结构、性质及变化规律的基础自然学科。同学们以氯化钠为例进行研究
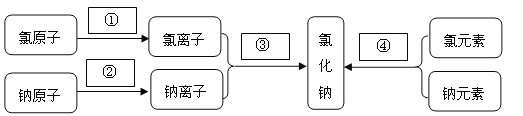
(1)研究物质的组成和结构:将失去电子、得到电子、构成和组成填在图中的空白处:
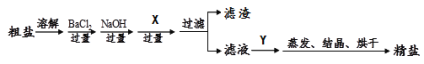
(2)研究物质的制备:将海水进行 可得到粗盐。除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,常加入过量的①过量的Na2CO3 溶液、② BaCl2溶液、③NaOH溶液,三种试剂的加入顺序为 (填序号)。碳酸钠和盐酸反应也能生成氯化钠,工业上不用此反应制备氯化钠的原因是 。
(3)研究变化规律:将氯化钠和水在通电条件下反应能生成一种碱、氢气和氯气(Cl2),该反应的化学方程式为 。
【答案】(1)①得到电子 ②失去电子 ③构成 ④组成
(2)蒸发结晶 ②③①或③②①或②①③ 碳酸钠、盐酸的成本比氯化钠高(或海水中富含氯化钠,成本低等)
(3)2NaCl +2H2O 通电2NaOH +2H2↑ + Cl 2↑
【解析】
试题分析:(1)①氯原子最外层电子数是7>4,故容易得到电子;②钠原子最外层电子数是1<4,容易失去电子;③从微观来讲:氯化钠由钠离子和氯离子构成;④从宏观来讲:氯化钠由钠元素和氯元素组成
(2)由于氯化钠的溶解度随温度的升高而变化不大,故从海水中得到粗盐采用蒸发结晶的方法;要除去粗盐中含有的SO42- 、Ca2+、Mg2+等杂质,常加入过量的①过量的Na2CO3 溶液(除去Ca2+及过量的BaCl2溶液)、② BaCl2溶液(除去SO42-)、③NaOH溶液(除去Mg2+),基于这种情况, 所以①过量的Na2CO3 溶液一定要放在② BaCl2溶液之后即可,故三种试剂的加入顺序为:②③①或③②①或②①③;碳酸钠和盐酸反应也能生成氯化钠,工业上不用此反应制备氯化钠的原因是:碳酸钠、盐酸的成本比氯化钠高(或海水中富含氯化钠,成本低等)
(3)将氯化钠和水在通电条件下反应能生成一种碱、氢气和氯气(Cl2),该反应的化学方程式为:2NaCl +2H2O 通电2NaOH +2H2↑ + Cl 2↑

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】(6分)一定条件下,某物质溶解于水的实验数据如下表,请回答有关问题。
实验序号 | 温度/℃ | 水的质量/g | 所加物质质量/g | 溶液质量/g |
① | 20 | 10 | 2 | 12 |
② | 20 | 15 | 2.5 | a |
③ | 20 | 20 | 7 | 26 |
④ | 30 | 20 | 7 | 27 |
(1)表中a= 。
(2)20℃时,该物质的溶解度为 。
(3)下图中,能表示该物质溶解度的曲线是 (填字母)。
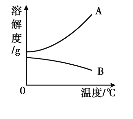
(4)所得溶液一定为饱和溶液的是 (填实验序号,下同);所得溶液中溶质质量分数最大的是 。
(5)温度不变,将①、②所得溶液混合后,向其中再加入 g该物质,能使溶液恰好达到饱和。