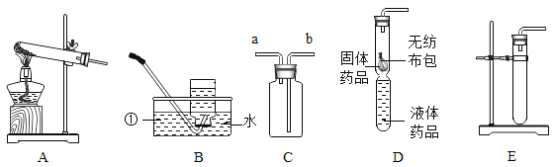
题目内容
【题目】认识物质要从物质的构成奥秘开始。
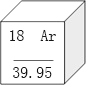
(1)如图是元素周期表中的一格。
①在如图元素周期表的空格处写上元素名称_____。
②该元素在元素周期表中位于第三周期的_____(填“最左边”“中间”或“最右边”)。
(2)已知某粒子的结构示意图如图(其中n≠0)。
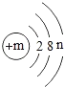
①若该粒子为原子,则n的最大值为____,此时m=____。
②若该粒子带两个单位的正电荷,则m的值为____。
③若m-n=10,则该粒子对应的常见金属元素有____(写元素符号)。
【答案】氩 最右边 8 18 20 Na、Mg、Al
【解析】
(1)①元素周期表中,方格中左上角是原子序数,右上角是元素符号,中间是元素名称,下面是相对原子质量;所以空格处元素名称为氩;
②由于氩原子的核外有三个电子层,最外层有八个电子,该元素在元素周期表中位于第三周期的最右边。
(2)①原子的最外层电子最多是8个,故n的最大值是8,此时m=2+8+8=18;
②)若该粒子带两个单位正电荷,且n=8,则该粒子的质子数是20,该离子是钙离子,符号为Ca2+,即m=20;
③若m-n=10,则m=10+n,该粒子对应的常见金属元素有Na、Mg、Al三种元素。

 名校课堂系列答案
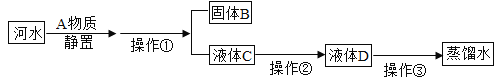
名校课堂系列答案【题目】二百多年前,法国化学家拉瓦锡定量的研究了空气的成分。以下两个实验是仿照这个历史上著名实验的原理进行了改进。
(1)图1装置是用红磷燃烧来粗略测定空气中氧气含量。写出集气瓶中物质燃烧的文字(或符号)表达式___________。此实验不仅可以测定氧气占空气的体积分数,还可以说明氮气具有的化学性质是________(只需写一点)。
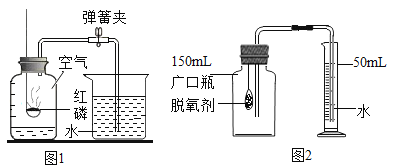
(2)食品脱氧剂(以铁粉为主的物质组成)能通过化学反150mL应除去密闭包装袋中的氧气,使食品处于无氧状态。张山同学用图2装置进行测定空气中氧气含量的实验。下表是张山同学在实验过程中记录的有关数据:
所需要的时间 | 0 | 5 | 10 | 30 | 35 | 45 |
量筒中液面的刻度 | 50 | 35 | 27.5 | 19.7 | 19.7 | 19.7 |
①脱氧剂发生复杂的化学反应,首先是铁粉与氧气、水反应生成氢氧化亚铁(Fe(OH)2)固体,写出该反应文字(或符号)表达式:______________。该反应属于________反应(填基本反应类型)。
②实验过程中观察到量筒中的液面不断下降,水被吸入广口瓶中,出现该现象的原因是____。
③分析表中数据得知,至少经过____分钟后,量简中的液面不再下降。根据表中实验数据进行推算,广口瓶中氧气的体积分数是________(结果精确到0.1%)。
④小虎同学的实验用时45分钟,结果发现广口瓶中收集到的水约为张山同学的1/3,请你着小虎同学找出造成实验失误的可能原因之一:__________。
⑤与燃烧红磷相比,用脱氧剂测定空气中氧气含量的优点是__________。
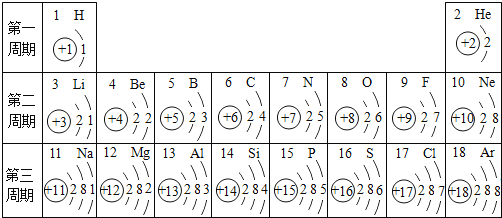
【题目】下表是元素周期表的部分信息,请回答下列问题:
1H 氢 | 2He 氦 | |||||||
3Li 锂 | 4Be 铍 | 5B 硼 | 6C 碳 | 7N 氮 | 8O 氧 | 9F 氟 | 10Ne 氖 | |
llNa 钠 | 12Mg 镁 | 13A1 铝 | 14Si 硅 | 15P 磷 | 16S 硫 | 17C1 氯 | 18Ar 氩 | |
19K 钾 | xCa 钙 | …… | ||||||
(1)地壳中含量最多的元素的原子序数是___________地壳中含量最多的金属元素是______ ,它和含量最多的非金属元素组成的化合物化学式___________,相对分子质量___________。
(2)分析上表可发现:每一横行元素从左向右排列所遵循的一条规律是____________。根据此规律,可知图中x = _________ ,它的离子符号是______,氧化物化学式为_______
(3)15号元素的原子结构示意图_____________ 。
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如图(氨气NH3):
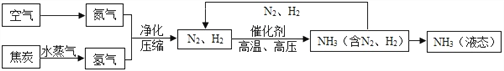
(1)合成氨气的反应必须在高温、高压、催化剂条件下进行,该反应的符号表达式是:____,属于_________(填基本反应类型)反应,该反应中的最小粒子是__________(填写化学符号)。
(2)生产过程中可重复使用的物质是___________(填化学式)。
(3)根据表中的数据回答问题
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105Pa) | ﹣252 | ﹣195.8 | ﹣183 | ﹣33.35 |
在1.01×105Pa时,欲将NH3与N2、H2分离,最好将温度控制在_______之间。