题目内容
【题目】以下是实验室常用的部分实验装置。请回答下列问题。
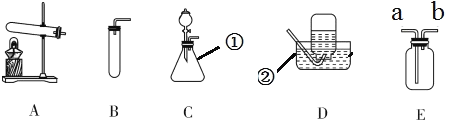
(1)仪器①②的名称分别是_____________、___________。
(2)实验室用过氧化氢溶液和二氧化锰可以制取氧气,该反应的符号表达式为______
(3) 加热高锰酸钾制取并收集氧气,应选用的装置是________(填写字母)。实验前应先_____________,再加入药品,实验结束时应注意先_____________,再熄灭酒精灯,以防发生倒吸。
(4)用装置E收集氧气,该气体应从_____________(填标号)端通入集气瓶。
【答案】锥形瓶 水槽 H2O2![]() H2O+O2 AD 检查装置的气密性 移出导管 a
H2O+O2 AD 检查装置的气密性 移出导管 a
【解析】
(1)仪器①的名称是锥形瓶;仪器②的名称是水槽。
(2)实验室用过氧化氢溶液和二氧化锰可以生成水互为仪器,该反应的符号表达式为H2O2 ![]() H2O+O2
H2O+O2
(3)加热高锰酸钾制取氧气属于固固加热型装置,故发生装置选A,由于氧气的密度比空气的密度大,不易溶于水,故收集氧气可以选D,故组合装置为AD。实验前应该先检查装置的气密性,实验结束时,应该先将导管从水面离开,后熄灭酒精灯,以免水倒吸,加入试管使试管破裂。
(4)装置E是多功能装置,收集氧气时,由于氧气的密度比空气的密度大,故氧气应该由长管a通入。

【题目】对空气中氧气含量测定的再认识。
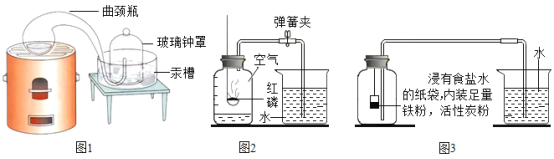
(经典赏析)科学家拉瓦锡用图1装置测定空气中氧气含量。该实验中选择汞为实验药品,把它放在密闭的容器里连续加热12天,发现一部分银白色的液态汞变成红色粉末,同时容器里空气的体积差不多减少![]() ,对应观察到的现象为______。
,对应观察到的现象为______。
(实验回顾)图2是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
(1)写出红磷燃烧的化学反应方程式:______。
(2)实验原理:由于红磷燃烧消耗空气中氧气,使瓶内减小,烧杯中水倒吸到集气瓶中。用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
(3)对该实验认识正确的是______。
A红磷燃烧产生大量白色的烟雾
B红磷的用量不足会导致测定氧气体积含量偏大
C红磷燃烧以后,若未冷却到室温便打开止水夹,会导致测定氧气体积含量偏小
D该实验可说明氮气难溶于水
(问题提出)某小组同学多次实验发现,集气瓶内上升的水面始终小于理论值。经查阅资料知:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测得结果与理论值相差较大。
(实验改进)Ⅰ.根据铁丝在空气中生锈的原理(铁与氧气和水发生反应生成铁锈)设计如图3实验装置,再次测定空气中氧气含量,装置中的食盐水和活性炭会加速铁生锈。
Ⅱ.测得实验数据如表:
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(1)根据表中数据计算,改进实验后测得的空气中氧气体积分数是_____。(消耗的水的体积忽略不计,计算结果精确到0.1%)。
(2)实验反思:从原理的角度分析,与红磷燃烧法相比,用铁丝生锈法测定空气中氧气含量的优点是_______。
(经典再识)科学家选择汞作为药品也有优点:汞的沸点为356.6℃,加热时源源不断气化的汞原子和空气中的氧分子发生的反应属于气相反应,反应可以达到完全,因此汞_______(填“能”或“不能”)将密闭容器内的氧气几乎耗尽!
【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为_______________g;
(2)原混合物中氯酸钾的质量是多少?_____________