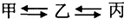题目内容
(8分)某化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究,查阅资料如下:
1、该牙膏摩擦剂由碳酸钙、氢氧化铝组成;
2、牙膏中其它成分遇到盐酸无气体生成;
3、碱石灰的主要成分为生石灰和氢氧化钠固体。
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀的质量,以确定碳酸钙的质量分数。请回答下列问题: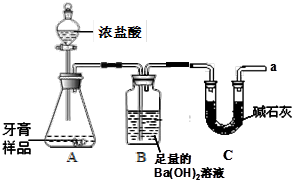
(1)B中反应生成BaCO3的化学方程式是 。
(2)C装置的作用是 。
(3)下列各项措施中,不能提高测定准确度的是 (填序号)。
| A.在加入盐酸之前,应排净装置内的CO2气体 |
| B.滴加盐酸不宜过快 |
| C.在A~B之间增添盛有浓硫酸的洗气装置 |
| D.在A~B之间增添盛有饱和碳酸氢钠溶液的洗气装置 |
,解决方法是 。
(5)某同学认为不必测定B中生成的BaCO3质量,将B中的Ba(OH)2溶液换成浓H2SO4 ,通过测定C装置反应前后的质量差也可以测定CaCO3的质量分数。实验证明按此方法测定的结果明显偏高,原因是 。
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。请计算样品中碳酸钙的质量分数。(写出计算过程)
(1)CO2 + Ba(OH)2 ="==" BaCO3↓ + H2O (2)吸收空气中的CO2 (3)CD
(4)产生的CO2未全部进入B装置 持续通入除去CO2的空气,使生成的气体被充分吸收
(5)挥发出的HCl和空气中的CO2、水蒸气等被C装置吸收 (6)25%
解析试题分析:(1)B中反应生成BaCO3,是由于A中生成了二氧化碳,二氧化碳与Ba(OH)2溶液反应,所以化学方程式:CO2 + Ba(OH)2 ="==" BaCO3↓ + H2O
(2)因为空气中也有二氧化碳,故通过C装置吸收空气中的CO2,防止空气中的二氧化碳也进入到装置B中,从而使生成的BaCO3的质量偏大,这样测得的碳酸钙质量分数不准确
(3)A、在加入盐酸之前,应排净装置内的CO2气体,如果没有排净,会增大生成BaCO3的质量,使测量结果不准确,B、滴加盐酸不宜过快,产生的二氧化碳来不及反应,就通过装置B直接排放到空气中去了,从而使生成的BaCO3的质量减少,C、在A~B之间增添盛有浓硫酸的洗气装置,只是除去水分,对二氧化碳的质量没有影响,D、在A~B之间增添盛有饱和碳酸氢钠溶液的洗气装置,会与挥发出来的盐酸反应生成二氧化碳,反而会增大二氧化碳的质量,故选C、D
(4)有同学认为该装置测定出来的碳酸钙质量分数会偏低,他的理由是生成的二氧化碳还有部分残留在装置A中,产生的CO2未全部进入B装置,为了解决这个问题,方法是:持续通入除去CO2的空气,是残留在装置A中的二氧化碳全部进入到装置B中,使生成的气体被充分吸收
(5)某同学认为不必测定B中生成的BaCO3质量,将B中的Ba(OH)2溶液换成浓H2SO4 ,通过测定C装置反应前后的质量差也可以测定CaCO3的质量分数。实验证明按此方法测定的结果明显偏高,原因是:挥发出的HCl和空气中的CO2、水蒸气等被C装置吸收
(6)根据化学方程式:CaCO3+2HCl==CaCl2+H2O+CO2↑,以及CO2 + Ba(OH)2 ==BaCO3↓+ H2O,根据BaCO3平均质量为3.94g,可算出二氧化碳的质量,进一步了算出碳酸钙的质量,便可求出样品中碳酸钙的质量分数
解:设二氧化碳的质量为x,碳酸钙质量为y
CO2 + Ba(OH)2 ==BaCO3↓+ H2O CaCO3+2HCl==CaCl2+H2O+CO2↑
44 197 100 44
x 3.94g y 0.88g
44:197=x:3.94g 100:44=y:0.88g
x=0.88g y=2g
∴样品中碳酸钙的质量分数=2g/8g×100%=25%
考点:二氧化碳的性质,干燥剂的作用,根据化学方程式进行的计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
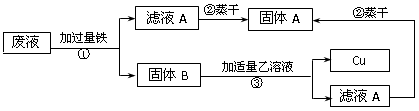
小学生10分钟应用题系列答案我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙).化学兴趣小组采用图乙装置,开展以下探究活动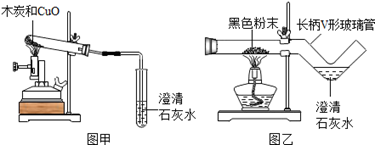
【提出问题】木炭与CuO反应所得红色固体中含有什么物质?
【查阅资料】
(1)木炭与CuO的反应是:C+2CuO 2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4═Cu+CuSO4+H2O
【作出猜想】红色固体的成分:①全部是Cu;②全部是Cu2O;③ .
【实验探究】
(1)取木炭、CuO两种黑色粉末适量,再也少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清的石灰水 ,此时停止加热.
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
| 步骤 | 现象 | 结论 |
| ①取1.44g红色固体装入试管,滴入足量的 ,充分反应 | 红色固体部分减少,溶为变 为 色 | 猜想 错误 |
| ②滤了试管中残留的红色固体,洗涤干燥,称其质量为1.04g | / | 猜想 正确 |
(1)使用图乙装置与使用图甲装置相比,其优点是 (写出1条即可).
(2)若要证明CaC12是该反应的催化剂,还需要验证CaCl2的 .
(3)在铜的冶炼史中,我国劳动人民还有一项重大发明就是“湿法炼铜”,该方法可用化学方程式表示为 .
铁是生产和生活中使用最多的金属材料,下列关于铁的叙述不正确的是( )
| A.铁生锈时生成四氧化三铁 |
| B.表面涂漆以防止铁生锈 |
| C.铁制品应放置于干燥的环境中 |
| D.经常清扫铁器表面灰尘可以防止铁生锈 |