题目内容
【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成,同学们查阅资料得知NaCl、CaCl2、BaCl2等溶液呈中性,经过思考,设计并进行了以下实验:
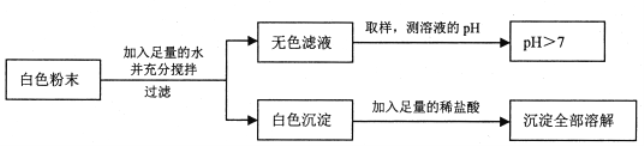
(1)白色粉末一定不含_____________,可能含有______________。
(2)为了确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
(提出问题)无色滤液中呈碱性的物质是什么?
(猜想假设)猜想一:NaOH
猜想二:______________
猜想三:Na2CO3和NaOH
(进行实验)
实验步骤 | 实验现象 | 结论 |
1.取少量该溶液于试管中 滴入_________溶液。 | _____________ | 猜想三正确 |
2.静置上述溶液,取少量上层清液于另一试管中,滴入几滴___________溶液。 | _______________ |
步骤1中发生反应的化学方程式为_______________。
(得出结论)白色粉末的成分是_________________。
【答案】硫酸铜和硫酸钠氢氧化钠Na2CO3过量氯化钡产生白色沉淀酚酞溶液颜色变红BaCl2+Na2CO3=BaCO3↓+2NaCl氯化钡、碳酸钠和氢氧化钠
【解析】
(1)白色粉末加水溶解得到无色溶液和白色沉淀,所以粉末中一定不含硫酸铜,白色沉淀加入稀盐酸,全部溶解,所以白色粉末中一定含有氯化钡、碳酸钠,一定不含硫酸钠,可能含有氢氧化钠;
(2)
猜想假设:碳酸钠、氢氧化钠都显碱性,都能使无色酚酞变红色,结合猜想一和猜想三,猜想二为Na2CO3。
进行实验:根据实验结论猜想三成立,故溶液中含有氢氧根离子和碳酸根离子,故先检验碳酸根离子并除去,防止干扰氢氧根离子的检验。故:
实验步骤1操作为:取少量该溶液于试管中滴入过量氯化钡溶液,必须是过量,以将碳酸根离子全部除去;实验现象为产生白色沉淀,该沉淀为碳酸钡;
实验步骤2的操作为:静置上述溶液,取少量上层清液于另一试管中,滴入几滴酚酞溶液,实验现象为溶液颜色变红;
步骤1中发生反应是氯化钡和碳酸钠反应生成碳酸钡和氯化钠,故该反应的化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl。
(3)
得出结论:结合第一小问和实验结论,可知白色粉末的成分是氯化钡、碳酸钠和氢氧化钠。

 阅读快车系列答案
阅读快车系列答案