题目内容
(2011年四川内江,13题)某研究性学习小组为测定铜锌合金中铜的质量分数,进行如下实验:取合金10g,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示。求:
①稀硫酸中溶质的质量分数。
②合金中铜的质量分数。
①稀硫酸中溶质的质量分数。
②合金中铜的质量分数。
解:由图示可知,当加入20g稀硫酸时,合金中的锌恰好反应完全,产生0.1g氢气
设参加反应的硫酸的质量为m,合金中锌的质量为n
Zn + H2SO4 ="=" ZnSO4 + H2↑
65 98 2
n m 0.1g
98 / m ="=" 2 / 0.1
m ="=" 4.9 g
①稀硫酸的溶质质量分数为:(4.9g / 20g)×100% ="=" 24.5%
65 / n ="=" 2 / 0.1g
n ="=" 3.25 g
②合金中铜的质量为:10g – 3.25g ="=" 6.75g
合金中铜的质量分数为:(6.75g / 10g)×100% ="=" 67.5%
答:稀硫酸的质量分数为24.5%,合金中铜的质量分数为67.5%。
设参加反应的硫酸的质量为m,合金中锌的质量为n
Zn + H2SO4 ="=" ZnSO4 + H2↑
65 98 2
n m 0.1g
98 / m ="=" 2 / 0.1
m ="=" 4.9 g
①稀硫酸的溶质质量分数为:(4.9g / 20g)×100% ="=" 24.5%
65 / n ="=" 2 / 0.1g
n ="=" 3.25 g
②合金中铜的质量为:10g – 3.25g ="=" 6.75g
合金中铜的质量分数为:(6.75g / 10g)×100% ="=" 67.5%
答:稀硫酸的质量分数为24.5%,合金中铜的质量分数为67.5%。
略

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
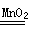 2 H2 O+O2↑从化学反应的基本类型来看,它们都属于 反应。
2 H2 O+O2↑从化学反应的基本类型来看,它们都属于 反应。