题目内容
【题目】某同学配制50g6%氯化钠溶液,整个操作过程如图1所示,回答下列问题:
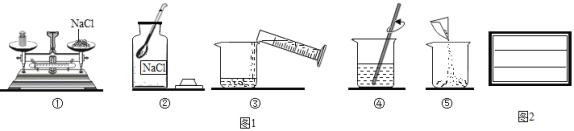
(1)配制溶液的正确操作顺序为_____(填序号,下同),其中操作错误的是_____。
(2)图②中盛放氯化钠固体的仪器名称是_____,需称取氯化钠_____g。
(3)量水时选用的量筒的量程最合适的是_____(填序号),读数时视线要与量筒内_____保持水平。
A 10mL B 25mL C 50mL D 100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是_____(填序号)。
A 氯化钠固体不纯 B 用生锈砝码称量
C 装瓶时有少量溶液洒出 D 溶解时烧杯内壁有水珠
(5)图④中玻璃棒的作用是_____。
(6)请你为该瓶溶液写上标签(图2)_____
(7)用已经配好质量分数为6%的氯化钠溶液,配制100g质量分数为3%的氯化钠溶液,所需6%氯化钠溶液的质量为_____g,加水的质量为_____g。
【答案】②①⑤③④ ① 广口瓶 3 C 凹液面的最低处 AD 搅拌,加速固体物质的溶解  50 50。
50 50。
【解析】
(1)配制配制50g 6%氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠的质量,量取所需水的体积,最后进行溶解,所以配制溶液的正确操作顺序为②①⑤③④。托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了。
(2)图②中盛放氯化钠固体的仪器是广口瓶;溶质质量=溶液质量×溶质的质量分数,配制50g 6%氯化钠溶液,需氯化钠的质量为:50g×6%=3g。
(3)溶剂质量=溶液质量-溶质质量,所需溶剂的质量为50g-3g=47g,47g水的体积是47mL,应用规格为50mL的量筒量取水的体积。读数量筒内液体的体积时,视线要与凹液面的最低处保持水平。
(4)A.氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,此选项符合题意;B.用生锈砝码称量,砝码质量偏大,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大,此选项不符合题意;C.溶液具有均一性,装瓶时有少量溶液洒出,溶质质量分数不变,此选项不符合题意;D.溶解时烧杯内壁有水珠,会造成实际水的体积偏大,则使溶质质量分数偏小,此选项符合题意。故选AD。
(5)图④中玻璃棒的作用是搅拌,加速固体物质的溶解;
(6)该瓶溶液写上标签如图: ;
;
(7)溶液稀释过程中溶质的质量相等,设需要6%氯化钠溶液的质量是x,则x×6%=100g×3%,解得x=50g,加水的质量为:100g﹣50g=50g。

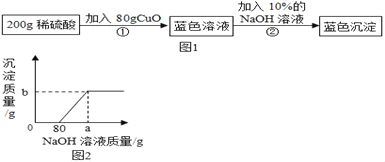
【题目】为了测定某碳酸钠样品中杂质氯化钠的质量,李明同学进行了三次实验,反应的化学方程式为:Na2CO3+CaCl2===CaCO3↓+2NaCl。实验数据如下表:
编号 | 第1次 | 第2次 | 第3次 |
所取固体样品的质量/g | 7 | 5 | 5 |
加入氯化钙溶液的质量/g | 50 | 50 | 75 |
反应后生成沉淀的质量/g | 4 | 4 | 4 |
完成下列计算:
(1)碳酸钠样品中碳酸钠的质量是多少?
(2)第三次实验中充分反应后所得溶液中氯化钠的质量分数是多少?