题目内容
 在学校的元旦联欢会上,某同学表演了“水能生火”魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.于是,他和同学们进行探究.
在学校的元旦联欢会上,某同学表演了“水能生火”魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.于是,他和同学们进行探究.【提出问题】过氧化钠与水反应生成什么物质?为什么脱脂棉会燃烧?
【猜想】①可能有一种气体和一种物质生成;②反应过程中可能有热量放出.
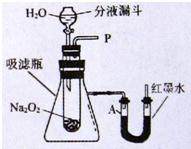
【设计装置】如图所示.
【实验探究】
实验一:探究反应后生成的气体是什么?
(1)打开装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃.说明生成的气体是
氧气
氧气
;(2)实验中还观察到烧杯中的导管口有气泡冒出,其原因是
反应放出的热量使吸滤瓶中空气温度上升,压强变大
反应放出的热量使吸滤瓶中空气温度上升,压强变大
;实验二:继续探究反应后生成的另一种物质是什么?
根据所学知识,小张猜想另一种物质是Na2CO3,小蔡认为不可能,小蔡的依据是
反应物质中没有碳元素
反应物质中没有碳元素
.【表达】由实验探究结果,写出过氧化钠与水反应的化学方程式:
2Na2O2+2H2O═4NaOH+O2 ↑
2Na2O2+2H2O═4NaOH+O2 ↑
.分析:(1)检验氧气要使用带火星的木条;
(2)反应放出热量,会导致吸滤瓶内压强增大,烧杯中的水会产生气泡;
(3)探究生成的物质要根据质量守恒定律,化学反应前后元素的种类不变据此分析即可;
(4)根据实验可知过氧化钠与水反应会生成氢氧化钠和氧气.
(2)反应放出热量,会导致吸滤瓶内压强增大,烧杯中的水会产生气泡;
(3)探究生成的物质要根据质量守恒定律,化学反应前后元素的种类不变据此分析即可;
(4)根据实验可知过氧化钠与水反应会生成氢氧化钠和氧气.
解答:解:实验一:(1)检验氧气用的使带火星的木条,现象是木条复燃,所以生成的气体是氧气;
(2)反应放出大量的热,则吸滤瓶内的气体温度升高,分子间的间隔增大,导致吸滤瓶内的压强增大,气体会向外逸出,故烧杯中会有气泡产生;
实验二:参加反应的物质为Na2O2和H2O,分析其元素组成,只有Na、H、O三种元素,根据质量守恒定律,生成物也应该含有这三种元素,所以生成的另一种物质只能是氢氧化钠,不可能是Na2CO3(其他答案合理均可);
表达:根据实验结果,反应后生成的物质为氢氧化钠和氧气,方程式为:2Na2O2+2H2O═4NaOH+O2↑.
故答案为:实验一:(1)氧气;
(2)反应放出的热量使吸滤瓶中空气温度上升,压强变大.
实验二:反应物质中没有碳元素.
表达:2Na2O2+2H2O═4NaOH+O2 ↑
(2)反应放出大量的热,则吸滤瓶内的气体温度升高,分子间的间隔增大,导致吸滤瓶内的压强增大,气体会向外逸出,故烧杯中会有气泡产生;
实验二:参加反应的物质为Na2O2和H2O,分析其元素组成,只有Na、H、O三种元素,根据质量守恒定律,生成物也应该含有这三种元素,所以生成的另一种物质只能是氢氧化钠,不可能是Na2CO3(其他答案合理均可);
表达:根据实验结果,反应后生成的物质为氢氧化钠和氧气,方程式为:2Na2O2+2H2O═4NaOH+O2↑.
故答案为:实验一:(1)氧气;
(2)反应放出的热量使吸滤瓶中空气温度上升,压强变大.
实验二:反应物质中没有碳元素.
表达:2Na2O2+2H2O═4NaOH+O2 ↑
点评:根据已有知识,在情景相似的情况下,进行知识地大胆迁移,是解决新问题的一种重要方法,推测生成物质的化学式时,要根据质量守恒定律.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
 18、在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na202)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小蔡很感兴趣,于是,他和同学们进行探究.
18、在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na202)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小蔡很感兴趣,于是,他和同学们进行探究. 25、“在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.”小颖看到这段话后非常感兴趣,她和同学们一起对该问题进行了一系列的探究.
25、“在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.”小颖看到这段话后非常感兴趣,她和同学们一起对该问题进行了一系列的探究.
 (2010?滨州)在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小明很兴趣,于是,他和同学们进行探究.
(2010?滨州)在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小明很兴趣,于是,他和同学们进行探究. 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小明很感兴趣,于是,他和同学们进行探究.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小明很感兴趣,于是,他和同学们进行探究.