题目内容
【题目】黄铜(铜锌合金)用作弹壳的制造。现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示。
【收集资料】弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应。
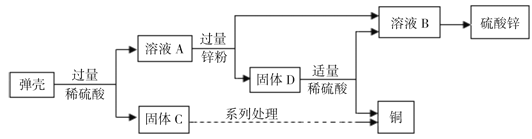
(1)写出溶液A与过量锌粉发生反应的化学方程式:
; 。
(2)固体D为 ;
(3)最终得到的硫酸锌中锌元素的质量 (填“>”、“=”或“<”)弹壳中锌元素的质量。
【答案】(1)Zn+H2SO4=ZnSO4+H2↑
Zn+CuSO4= Cu +ZnSO4(2)锌、铜(3)>
【解析】
试题分析:(1)根据资料:弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液,由于所加的稀硫酸是过量的,故溶液A中的溶质除了反应生成的硫酸铜,还有过量的硫酸,故溶液A与过量锌粉发生反应的化学方程式:Zn+H2SO4=ZnSO4+H2↑ ,Zn+CuSO4= Cu +ZnSO4
(2)固体D中除了反应生成的铜,还有过量的锌,故成分为:锌、铜
(3)由于反应过程中加入了过量的锌,全部转化为硫酸锌,故最终得到的硫酸锌中锌元素的质量>弹壳中锌元素的质量

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下列实验方案正确的是( )
序号 | 实验目的 | 实验方案 |
A | 除去氯化氢中的水蒸气 | 通过足量的氢氧化钠固体 |
B | 检验某气体是否为二氧化碳 | 用燃着的木条伸入该气体中 |
C | 除去硫酸钾溶液中的硫酸镁 | 滴加适量的氢氧化钠溶液 |
D | 不用其它试剂,鉴别①稀硫酸②氢氧化钠溶液③氯化铁溶液 | 鉴别出的先后顺序可以是③②① |