题目内容
【题目】为了验证燃烧的条件,同学们设计了如图所示的实验,把同样大小的滤纸碎片和乒乓球碎片分开放在一块薄铜片的两侧,加热铜片的中部。

(1)实验中使用铜片,是利用了铜的_____性。
(2)铜片受热的一面变黑,是因为产生了_____。
(3)实验中发现乒乓球碎片先燃烧起来,说明燃烧需要的条件之一是_____。
【答案】导热 氧化铜 温度达到可燃物的着火点
【解析】
(1)金属有良好的导热性,实验中使用铜片,是利用了铜的导热性使滤纸碎片和乒乓球碎片燃烧。故填:导热;
(2)铜在加热的条件下会与氧气反应生成黑色的氧化铜。故填:氧化铜;
(3)滤纸碎片和乒乓球碎片都与氧气接触,在加热过程中,由于乒乓球碎片的着火点较低,首先燃烧起来,说明燃烧需要温度达到可燃物的着火点。故填:温度达到可燃物的着火点。

 阅读快车系列答案
阅读快车系列答案【题目】化学兴趣小组的同学将光亮的镁条插入滴有酚酞的饱和NaHCO3溶液中,产生大量气泡和白色固体,溶液红色加深。某化学兴趣小组同学对这一异常现象产生了兴趣,为探究产生气体的成分和白色固体的成分,他们分组进行了如下实验。
[查阅资料]Mg(OH)2难溶于水,MgCO3微溶于水;MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
探究实验一-:
[提出问题]产生的气体是什么?
[作出猜想]猜想1:H2 猜想2:CO2 猜想3:H2 和CO2
[实验验证]
实验方案 | 实验步骤及现象 | 实验结论 |
① | 收集生成的气体,将气体通入澄清石灰水中,观察到__________________________。 | 猜想2、3不成立 |
② | 收集生成的气体,将气体通过浓硫酸后点燃,气体安静燃烧,火焰呈淡蓝色,在火焰上方罩一个干冷的烧杯,内壁有水雾 | 猜想1成立 |
探究实验二:
[提出问题)生成的白色固体是什么?
[作出猜想]猜想1:MgCO3 猜想 2:Mg(OH)2 猜想3:MgCO3和Mg(OH)2
[实验验证]
实验方案 | 实验步骤 | 实验结论 |
① | 取白色固体加入足量稀盐酸,,有大量气泡生成,产生气泡的化学方程式为_________________。 | 猜想_______________________不成立 |
② | 取白色固体干燥后,充分加热至不再产生气体,将产生的气体先通过碱石灰,再通过浓硫酸,发现碱石灰增重,浓硫酸质量不变 | 猜想1成立 |
[反思交流]
(1)探究实验二中实验方案②将白色固体干燥后再加热的目的是___________________。
(2)其他同学认为探究实验二结论不正确,原因是_________________________,改进方法是_________________________。
【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
编号 | 实验药品 | 分解温度(°C) |
Ⅰ | 3.0gKC1O3与1.0gMnO2均匀混合加热 | 150 |
Ⅱ | xg KC1O3与 1. 0g CuO均匀混合加热 | 170 |
Ⅰ中反应的化学方程式是_____________________________。
Ⅱ中x的值应为_____________________________。
[实验结论]实验 所用两种金属氧化物中,催化效果最好的是_____________________________。
(2)乙探究了影响双氧水分解速率的某种因素,实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0 g | 1% | 0.1 g | 9 mL |
Ⅱ | 50.0 g | 2% | 0.1 g | 16mL |
Ⅲ | 50.0 g | 4% | 0.1 g | 31mL |
本实验中,测量O2体积的装置是__________________________________________(填编号)。
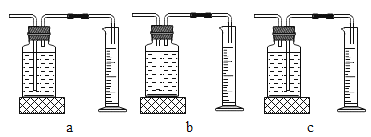
[实验结论]在相同条件下,_____________________________,双氧水分解得越快。/span>
[反思]丙用如图装置进行实验:
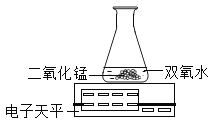
通过比较_____________________________也能达到实验目的。