题目内容
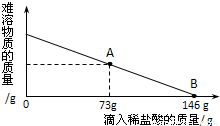
向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )| 序号 | 烧杯中的物质 | x溶液 |
| ① | 铜锌合金 | 稀HCl |
| ② | 盐酸与稀硫酸 | BaCl2溶液 |
| ③ | 生锈的铁钉 | 稀HCl |
| ④ | HCl和MgCl2溶液 | NaOH溶液 |

A.①②
B.②③
C.①④
D.③④
【答案】分析:此类是一种化学反应的现象和过程由图示给出的一种信息题型,解题的关键或突破口在于读懂题中给予的信息,结合化学反应的现象,才能准确做出判断.
解答:这是一种组合选择题.题中可供选择的答案较多,而符合题干要求的又往往不止一个答案,一种方法是先从①②③④等备选答案中选出符合题意的答案,再从A、B、C、D等选项中找出由上述答案序号组合起来的选项作为正确答案.另一种方法是“淘汰法”,常在对某些备选答案拿不定主意时使用.这种方法就是将含有肯定不符合题意答案序号的选项淘汰掉,剩下的就是正确答案.
①铜锌合金和稀盐酸混合时,根据金属的活动性规律,其中锌和稀盐酸反应,生成物中一开始一定就有氢气生成,与第二个图中给予的气体,加入一定量的稀盐酸后有气体产生不符.
②盐酸和稀硫酸混合物,与氯化钡溶液混合时,一开始就有硫酸钡沉淀生成,同样与第二个图中的信息加一会氯化钡溶液才生成不符.
③生铁的铁钉,与稀盐酸混合时,首先稀盐酸和铁锈反应,过一会多余的稀盐酸才和铁反应生成氢气,所以符合第二个图示的信息.
④稀盐酸和氯化镁溶液,再加入氢氧化钠溶液时,首先氢氧化钠和稀盐酸中和反应,过量的氢氧化钠才和氯化镁反应生成氢氧化镁沉淀,符合第二图示.所以只有③④符合图中给予的信息.
故选D.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,所以解答此类题型时,对化学实验不仅要认真观察,还应掌握观察实验现象的方法,以及图中给予的信息.
解答:这是一种组合选择题.题中可供选择的答案较多,而符合题干要求的又往往不止一个答案,一种方法是先从①②③④等备选答案中选出符合题意的答案,再从A、B、C、D等选项中找出由上述答案序号组合起来的选项作为正确答案.另一种方法是“淘汰法”,常在对某些备选答案拿不定主意时使用.这种方法就是将含有肯定不符合题意答案序号的选项淘汰掉,剩下的就是正确答案.
①铜锌合金和稀盐酸混合时,根据金属的活动性规律,其中锌和稀盐酸反应,生成物中一开始一定就有氢气生成,与第二个图中给予的气体,加入一定量的稀盐酸后有气体产生不符.
②盐酸和稀硫酸混合物,与氯化钡溶液混合时,一开始就有硫酸钡沉淀生成,同样与第二个图中的信息加一会氯化钡溶液才生成不符.
③生铁的铁钉,与稀盐酸混合时,首先稀盐酸和铁锈反应,过一会多余的稀盐酸才和铁反应生成氢气,所以符合第二个图示的信息.
④稀盐酸和氯化镁溶液,再加入氢氧化钠溶液时,首先氢氧化钠和稀盐酸中和反应,过量的氢氧化钠才和氯化镁反应生成氢氧化镁沉淀,符合第二图示.所以只有③④符合图中给予的信息.
故选D.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,所以解答此类题型时,对化学实验不仅要认真观察,还应掌握观察实验现象的方法,以及图中给予的信息.

练习册系列答案
相关题目
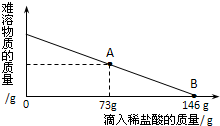 在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图X所示:
在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图X所示:
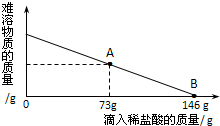 在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图X所示:
在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图X所示: