题目内容
【题目】同学们为了探究盐酸和氢氧化钠是否发生反应,设计并进行了实验。
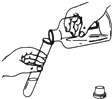
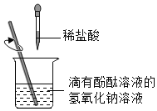
(1)小丽同学用如图进行实验,实验中观察到________现象能证明盐酸和氢氧化钠发生了化学反应,其理由是________。
(2)小明同学用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
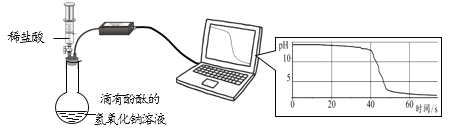
①盐酸和氢氧化钠反应的化学方程式为________。
②60 s时,烧瓶内溶液中的溶质有__________。
【答案】溶液由红色变为无色 氢氧化钠溶液能使酚酞试液变为红色,实验中溶液由红色变为无色,说明溶液不是碱性了,即氢氧化钠已反应完 NaOH+HCl==NaCl+H2O HCl、NaCl
【解析】
(1)酚酞试液遇碱性溶液变红,氢氧化钠溶液显碱性,所以可观察到溶液由红色变为无色。氢氧化钠溶液能使酚酞试液变为红色,实验中溶液由红色变为无色,说明溶液不是碱性了,即氢氧化钠已反应完。
(2)①盐酸和氢氧化钠反应生成氯化钠水。②60 s时,烧瓶内溶液的pH<7,溶液显酸性,所以溶液中的溶质有生成的NaCl和过量盐酸中的HCl。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钙元素对人类生命和生活具有重要意义,含钙的物质是中学化学研究的重要内容。
(1)牛奶中的钙主要以磷酸钙(Ca3(PO4)2 的形式存在,磷酸钙中磷元素的化合价为_____价。
(2)生石灰溶于水可制得熟石灰,该反应过程中能量的变化是_____(填“吸热”或“放热”)。
(3)氢化钙固体是登山运动员常用的能源提供剂某研究小组的同学通过查阅资料得知:氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。该研究小组的同学把一定量的氢化钙加入到碳酸钠溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:氢氧化钠
猜想二:氢氧化钠、氢氧化钙
猜想三:氢氧化钠、碳酸钠
猜想四:氢氧化钠、碳酸钠、氢氧化钙
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明理由_____。
(实验验证)
实验 | 现象 | 结论 |
①取少量滤液,向其中滴加少量碳酸钠溶液 | 无明显现象 | 猜想_____不成立 |
②另取少量滤液,向其中滴加足量稀盐酸 | _____ | 猜想三成立 |
(反思与拓展)
①要证明猜想三成立,也可以另取少量滤液,向其中滴加_____。
②在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑_____。
③登山运动员携带氢化钙作为能源提供剂与携带氢气相比,其优点是_____(写一条即可)。
【题目】阅读下列短文并回答问题。
甲烷——看不见摸不着但是很强大(节选)
据记载,我国是最早发现并使用甲烷的国家,《易经》中就谈到“象曰:泽(沼泽)中有火。”
什么是甲烷呢?
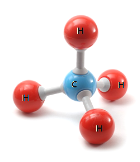
甲烷,是最简单的有机物。甲烷分子为正四面体结构(如图)。标准状态下的甲烷是一种无色无味的气体。
甲烷与全球变暖有关吗?
甲烷也是一种温室气体。甲烷的浓度对温室效应的影响如何?它与 CO2的温室效应哪个更强呢?科学家做了以下研究。
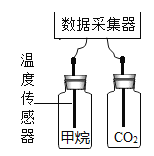
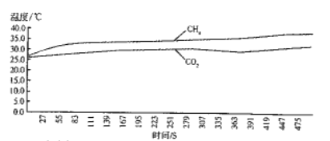
实验一:甲烷与CO2温室效应的对比探究如图,分别收集两瓶相同体积的甲烷气体和CO2气体,用温度传感器穿过塞子中间的小孔插入玻璃瓶中。将2瓶气体放在室外的阳光下,打开数据采集器,每秒采集一次数据,实验数据记录如下图:
实验二:不同体积分数的甲烷的温室效应的对比探究
仍然采用实验1的方法,分别收集下列四种体积分数的甲烷样品进行实验,表中为此实验的平均值。
不同体积分数甲烷在阳光照射下的平均温度
甲烷体积分数 | 18% | 36% | 48% | 64% |
太阳光照射时甲烷的平均温度/C | 28.4 | 30.1 | 31.7 | 32.8 |
甲烷从哪里来?
大气中甲烷的 30%~40%是由自然源引起的,70%左右是由人类活动产生的。如:化石燃料开采过程中泄漏;种植水稻其根部的有机物质在厌氧环境下转化形成的甲烷;饲养的牛等反刍动物其食物在消化过程会产生甲烷;固体的垃圾填埋等。
回答下列问题:
(1)“泽(沼泽)中有火”体现了甲烷具有的性质是________;
(2)依据甲烷的分子模型计算出甲烷中碳元素的化合价为_________;
(3)甲烷被称为“清洁的燃料”其理由是_____________(请用化学反应方程式解释原因);
(4)通过观察实验一和实验二的数据可知_______________(写出1条即可);
(5)要控制甲烷的排放从而降低其对温室效应的影响可采取的措施是_____。(写出1条即可)