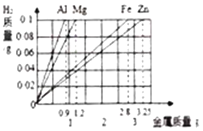
题目内容
【题目】下图为实验室常用的制取和收集气体的装置,请回答下列问题。
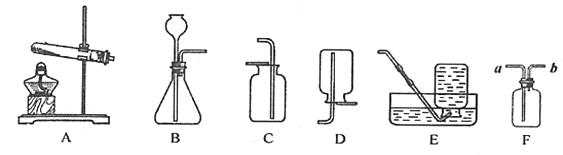
(1)实验室用A装置制氧气,该反应的化学方程式为______,为了获得较干燥的氧气,应选用的收集装置是______(填序号)。
(2)实验室制取![]() 的化学方程式是______,应选用装置______(填序号)。
的化学方程式是______,应选用装置______(填序号)。
(3)F为多功能瓶,该瓶可用作干燥(或收集气体),若要干燥二氧化碳气体,F中应盛有的试剂为______,若要收集氢气,则氢气应从______口通入(填“a”或“b”)。
【答案】![]() C
C ![]() BC或BF 浓硫酸 b
BC或BF 浓硫酸 b
【解析】
(1)A装置属于固体加热型发生装置,且试管口有棉花,说明是实验室用高锰酸钾制氧气的装置,高锰酸钾受热生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4![]() K2MnO4+ MnO2+O2↑;氧气密度比空气大且不与空气中各物质发生反应,可以采用向上排空气法,氧气也不易溶于水且不和水反应,可以才用排水法收集,为了获得较干燥的氧气,应选用排空气法收集,故填C;
K2MnO4+ MnO2+O2↑;氧气密度比空气大且不与空气中各物质发生反应,可以采用向上排空气法,氧气也不易溶于水且不和水反应,可以才用排水法收集,为了获得较干燥的氧气,应选用排空气法收集,故填C;
(2)实验室常用块状的大理石或石灰石和稀盐酸反应制取CO2,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;由于反应物是固体和液体,反应条件不需要加热,二氧化碳可溶于水且能和水反应,不能采用排水法收集,但由于二氧化碳密度比空气大且不和空气中各成分反应,能采用向上排空气法收集,所以制取二氧化碳的装置为BC或BF;
(3)干燥气体时,干燥剂不能和被干燥的气体发生反应,若要干燥二氧化碳气体,F中应盛放浓硫酸;若要收集氢气,由于氢气密度比空气小,氢气应从b口通入。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】(科学探究)在一次实践活动中,化学兴趣小组的同学在实验室利用稀硫酸、Ba(NO3)2溶液、Na2CO3溶液、NaOH溶液模拟化工厂工业废水的处理过程。
(活动一)将四种溶液两两混合判断能否发生反应。
(1)四种溶液中能彼此发生反应的有_____组,写出其中一个反应的化学方程式:_____。
(2)能发生反应但没有明显现象的一组物质反应的微观本质是_____。
(3)实验完毕,同学们将废液倒入同一个大烧杯中,静置,观察,杯底有白色沉淀,上层溶液为无色。并对白色沉淀和上层无色溶液的成分进行了进一步的探究。
(活动二)探究白色沉淀的成分
(进行猜想)猜想①:白色沉淀是Ba2SO4:猜想②:白色沉淀是BaSO4和BaCO3的混合物。
(实验验证)
实验步骤 | 现象 | 结论 |
取少量白色固体于试管中,向其中加入适量的稀硝酸 | _____ | 猜想②正确 |
(活动三)探究废液杯中无色溶液的成分。
①质疑1:小强认为在反应物中有酸,反应的生成物中也有酸,所以无色溶液中就一定含有酸。但小红提出了不同的观点,她认为_____。同学们一致同意小红的观点。
②检验溶液的酸碱度:所用实验用品有_____,经测定溶液的pH>7,呈碱性。
③(如图)
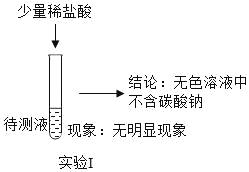
质疑Ⅱ:小林认为实验1不能证明无色溶液中不含碳酸钠,理由是_____,要证明溶液中不含有碳酸钠的实验方案是_____。
得出结论:无色溶液中一定含有的溶质是_____(填化学式)。
(反思与交流)工厂排放出的废液常呈酸性或碱性,排放前我们必须进行处理。
【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | m | 0.04 | 0.02 |
试求:
(1)m的数值_____。
(2)此黄铜样品中铜的质量分数是少?_____(写出计算过程)