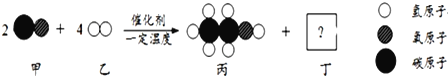
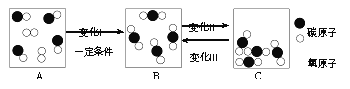
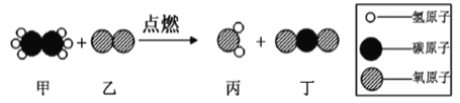
题目内容
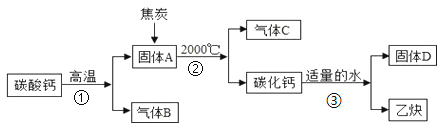
【题目】工业上生产电石(CaC2)制备重要工业原料乙炔(CxHy)流程如下:
请回答下列问题:
(1)写出碳酸钙高温分解①的化学方程式____________________;B、C组成的元素相同,C有毒,则反应②的化学方程式____________________;根据反应③可推断固体D中一定含有的元素是____________________。
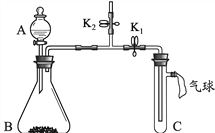
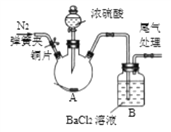
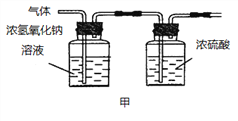
(2)已知:浓硫酸具有强吸水性。一个乙炔分子由4个原子构成。为了测定乙炔的组成,将一定量的乙炔(CxHy)完全燃烧,并将生成的气体缓缓通过下图的__________(选填“甲”或“乙”)装置,再缓缓通过一段时间的N2,缓缓通过一段时间的N2的目的是__________。
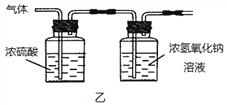
记录实验数据如下:
装置 | 反应前质量 | 反应后质量 |
浓硫酸 | 125.3g | 127.1g |
浓氢氧化钠溶液 | 78.2g | 87.0g |
根据实验数据推断乙炔的化学式(写出推断过程):__________
【答案】 CaCO3![]() CaO+CO2↑ CaO+3C
CaO+CO2↑ CaO+3C![]() CaC2+CO↑ 乙 使生成的气体完全被吸收 乙炔中氢元素的质量:(127.1g-125.3g)×
CaC2+CO↑ 乙 使生成的气体完全被吸收 乙炔中氢元素的质量:(127.1g-125.3g)×![]() =0.2g,乙炔中碳元素的质量:(87.0g-78.2g)×
=0.2g,乙炔中碳元素的质量:(87.0g-78.2g)×![]() =2.4g,根据题意有:
=2.4g,根据题意有:![]() =
=![]() ,解得
,解得![]() =
=![]() C2H2
C2H2
【解析】 (1)碳酸钙高温分解的化学方程式为:CaCO3![]() CaO+CO2↑,B、C组成的元素相同,C有毒,则C是CO,B是CO2。化学反应前后元素种类不变,各种原子个数相等,故反应的化学方程式为:CaO+3C
CaO+CO2↑,B、C组成的元素相同,C有毒,则C是CO,B是CO2。化学反应前后元素种类不变,各种原子个数相等,故反应的化学方程式为:CaO+3C![]() CaC2+CO↑,根据化学反应前后元素种类不变,可推断固体D中一定含有的元素是钙元素和氧元素。(2)将一定量的乙炔完全燃烧,生成的气体全部缓缓通过乙装置,这样可以避免气体通过氢氧化钠溶液时带出的水蒸气,故选乙。再缓缓通过一段时间的N2,目的是使生成的气体完全被吸收。浓硫酸增加的质量是生成水的质量,所以生成水的质量为:127.1g-125.3g=1.8g,浓氢氧化钠溶液增加的质量是生成二氧化碳的质量,所以生成二氧化碳的质量为:87.0g-78.2g=8.8g。1.8g水中氢元素的质量为:1.8g×
CaC2+CO↑,根据化学反应前后元素种类不变,可推断固体D中一定含有的元素是钙元素和氧元素。(2)将一定量的乙炔完全燃烧,生成的气体全部缓缓通过乙装置,这样可以避免气体通过氢氧化钠溶液时带出的水蒸气,故选乙。再缓缓通过一段时间的N2,目的是使生成的气体完全被吸收。浓硫酸增加的质量是生成水的质量,所以生成水的质量为:127.1g-125.3g=1.8g,浓氢氧化钠溶液增加的质量是生成二氧化碳的质量,所以生成二氧化碳的质量为:87.0g-78.2g=8.8g。1.8g水中氢元素的质量为:1.8g×![]() =0.2g,8.8g二氧化碳中碳元素的质量为:8.8g×
=0.2g,8.8g二氧化碳中碳元素的质量为:8.8g×![]() =2.4g,根据题意有:
=2.4g,根据题意有:![]() =
=![]() ,解得
,解得![]() =
=![]() , 因为一个乙炔分子由4个原子构成,所以乙炔的化学式是C2H2
, 因为一个乙炔分子由4个原子构成,所以乙炔的化学式是C2H2