��Ŀ����
����Ŀ����ɽ��ˮ�к��д�����H2SO4��CuSO4��ֱ���ŷŻ�Ӱ��ˮ������ԣ�������ؽ�����Ⱦ��ͨ���������Ի��ս���ͭ����ʹ��ˮpH���ؽ��������ﵽ�ŷű���
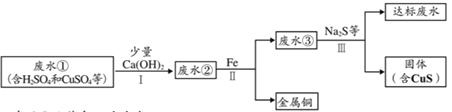
��֪������I����ɫ�������ɡ�
��1�������Ͳ��������еIJ�����_______��
��2�������õ�����ͭ�ķ�Ӧ�Ļ�ѧ����ʽΪ_______��
��3������Ca(OH)2���Խ�����м����������ԭ����_______���������ֲ���ϻ�ѧ����ʽ���ͣ���
��4������������Na2S����ʹ��ˮ�ﵽ�ŷű����ɴ��Ʋ��ˮ�۲�������Ҫԭ�� �����к���_______��
���𰸡� ���� Fe + CuSO4 ==== Cu + FeSO4 Ca(OH)2�����ˮ�е����ᷢ����Ӧ��Ca(OH)2+H2SO4====CaSO4+2H2O�������˷�ˮ�е����ᣬ��������м������ķ�Ӧ��Fe+H2SO4====FeSO4+H2 �� CuSO4����Cu2+��
����������1�����ݹ�Һ���뿼�Dz������裻
��2��������������ͭ��Ӧ����ͭ������������Ӧ������
��3�������������������ᷴӦ��������ƺ�ˮ���������ᷴӦ������������������������
��4�����ݲ���������CuS�������
�⣺��1�������Ͳ�����ǽ��й����Һ��ķ��룬�ʶ�����еIJ����ǹ��ˣ�
��2����������ͭ��Ӧ����ͭ��������������Ӧ�Ļ�ѧ����ʽΪFe + CuSO4 =Cu + FeSO4��
��3������Ca(OH)2���Խ�����м����������ԭ����Ca(OH)2�����ˮ�е����ᷢ����Ӧ��Ca(OH)2+H2SO4=CaSO4+2H2O�������˷�ˮ�е����ᣬ��������м������ķ�Ӧ��Fe+H2SO4=FeSO4+H2 ����
��4�����ڲ���������CuS���ʲ���������Na2S����ʹ��ˮ�ﵽ�ŷű����ɴ��Ʋ��ˮ�۲�������Ҫԭ�������к���CuSO4����Cu2+����

 ÿ��10���ӿ�����������������ϵ�д�
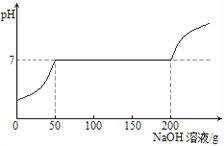
ÿ��10���ӿ�����������������ϵ�д�����Ŀ����2016��ɽ��ʡ�����С����������ʷֱ����ˮ�У���ֽ��裬���Եõ���Һ���ǣ� ��
A�������� B����� C������ D������
����Ŀ����7�֣�ij��ѧ��ȤС������ͼװ�����ľ̿��ԭ����ͭ��ʵ�飬�������ɵĺ�ɫ����ɷֽ���̽����
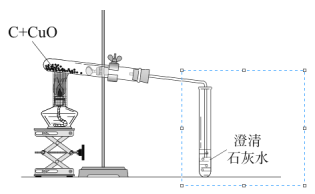
�����������ľ̿������ͭ��Ӧ���ɵĺ�ɫ�����к���ʲô���ʣ�
������������ľ̿������ͭ��ӦҲ��������������ͭ��Cu2O����������ͭ�Ǻ�ɫ���壬����ϡ���ᷴӦ��Cu2O+H2SO4![]() Cu+CuSO4+H2O��
Cu+CuSO4+H2O��
�����в�����ľ̿������ͭ��Ӧ���ɵĺ�ɫ����ɷ֣�
��ȫ����ͭ�� ��ȫ���� �� �������ߵĻ���
��ʵ��̽����
��1������ͼװ�����ľ̿��ԭ����ͭ��ʵ�飬�۲쵽����ʯ��ˮ ��
��2���Թ���ȴ�۲쵽��ɫ����ȫ����Ϊ��ɫ�������ɵĺ�ɫ����ɷֽ���̽����
�� �� | �� �� | �� �� |
��ȡ1.8g��ɫ�������Թ��У� �μ����� ����ַ�Ӧ | ����ٴ��� | |
�ڹ��ˣ�������ϴ�ӡ�������� | ���ù������� | �������ȷ |
����˼��������ľ̿��ԭ����ͭ��ʵ���У����ɵ�������ܺ���һ����̼��Ϊ�˷�ֹ�Կ��������Ⱦ���ɽ���ͼ���߷����ڵ�װ�ø�Ϊ ��ѡ����ĸ����