��Ŀ����
�±���KCl�ڲ�ͬ�¶�ʱ���ܽ�ȣ�
| �¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| �ܽ��/g | 27.6 | 31.0 | 34.0 | 37.0 | x | 42.6 | 45.5 |
| ʵ���� | ʵ��1 | ʵ��2 | ʵ��3 | ʵ��4 |
| KCl����/g | 5 | 15 | 25 | 35 |
| ��Һ����/g | 55 | 65 | 70 | 70 |
��1��ʵ������Ҫ�õ����������� ����ֻдһ�֣���
��2��Ҫʹʵ��2����Һ�ﵽ���ͣ��ɲ�ȡ�ķ������� ����
��3����ʵ���֪��40��ʱKCl���ܽ��xΪ�� �� g��
��4��С����Ҫ������������Ϊ30%��KCl��Һ100g��Ϊ��ʵ��Ŀ������Ҫ�������� ����
��1���ձ� ��2���������ʡ������¶ȡ������ܼ� ��3��40
��4��ˮ���¶�������50�����ϣ���ȡ30gKCl��������70gˮ�У�
���������������1�������ܽ�ʵ��ʱ��Ҫ�IJ����������ձ����������ȣ�����ձ���
��2�����ݱ�1��֪�Ȼ��ص��ܽ�����¶����߶�����Ҫʹ�䲻������Һ��Ϊ������Һ�����Բ����������ʡ������¶Ȼ��������ܼ��ķ���������������ʡ������¶ȡ������ܼ���
��3�����ݱ�2�ṩ�����ݣ���ȡˮ������Ϊ50g���������Ȼ���25g��35gʱ����Һ����������70g��˵��40��ʱ50gˮ������ܽ��Ȼ���20g����100gˮ������ܽ�40g���40��
��4��������������Ϊ30%��KCl��Һ100g������Ҫ�Ȼ��ص�����Ϊ100g��30%=30g����Ҫˮ������Ϊ100g��30g=70g����ʱ100gˮ���ܽ��Ȼ��ص�����Ϊ��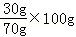
��42.9g�����ݱ�1�ܽ�ȣ���֪�¶���Ҫ���ߵ�50�����ϣ����ˮ���¶�������50�����ϣ���ȡ30gKCl��������70gˮ�У�
���㣺�����ܽ�ȵ�Ӱ�����أ�һ������������������Һ�����ƣ�������Һ�Ͳ�������Һ�ת��ķ����������ܽ�ȵĸ��
���������⿼���˹��������ܽ�ȵ��йؼ��㣬��ɴ��⣬���������ṩ����Ϣ���У�

��ͼ�Ǽס������ֹ������ʵ��ܽ�����ߣ�
��1����t1��ʱ���ס������ֹ������ʵ��ܽ�� ������Ȼ���ȣ���
��2���Ѽ����ʵIJ�������Һ��ɱ�����Һ�������й�˵����ȷ���� ����������ţ���
| A���ܼ�������һ����С |
| B�����ʵ�����һ������ |
| C�����ʵ���������һ����� |
| D����Һ���������ܲ��� |
��3����ʵ�����У��ù������ʼ�ˮ���Ƴ�һ������������������Һ�����õ��������У�������ƽ���ձ���ҩ�ס���ͷ�ιܺ� ��
��ͼ�Ǽס������ֹ������ʵ��ܽ�����ߡ�
��1����t1��ʱ���ס������ֹ������ʵ��ܽ�� ������Ȼ���ȣ���
��2���Ѽ����ʵIJ�������Һ��ɱ�����Һ�������й�˵����ȷ���� ������ĸ��ţ���
| A���ܼ�������һ����С |
| B�����ʵ�����һ������ |
| C���ñ�����Һ�������ܽ��������� |
| D����Һ���������ܲ��� |
��20��ʱ����������Ϊ50g��5��ˮ�зֱ����һ���������Ȼ��ع��壬Ȼ���������ȫ�ܽ�õ���Һ�����в��ܽ���Ȼ��أ�����˳�ȥ���������Ȼ��ص�������������Һ���������±���
| ʵ���� | 1 | 2 | 3 | 4 | 5 |
| �����Ȼ��ص�����/g | 5 | 10 | 15 | 20 | 25 |
| ��Һ������/g | 55 | 60 | 65 | 67 | 67 |
��1����20��ʱ��ʵ��3���õ���Һ���������ܼ�����֮��Ϊ_________��
��2����20��ʱ��ʵ��5���õ���Һ�����ʵ�����Ϊ_________g��
��3����20��ʱ��ʵ��1���õ���ҺΪ��������Һ������ͨ��________________�ķ���ʹ����Ϊ������Һ��
��4����20��ʱ��������Һ����������������ʵ��3____ ʵ��4____ ʵ��5���á�����������=����գ�
������һ��Ӫ�����ߵ�ˮ������Ϊ���зḻ�������ᣬ����Ϊ��������ֿ⡱���������гɱ�����Ƭ�����¿�ˮ�У������ڱ��������е�Ӫ�����ʡ���������һ����Ҫ���л��ᣬ���й���������������������( )
| A��ÿ������������к��и�̼ԭ��8��ԭ�ӡ�7����ԭ�� |
| B����������ʹ��̪��Һ����ɫ���ɫ |
| C���������еĵ���Ԫ�ص������������ |
| D����ˮ�м��������İ��ǡ���֭���������С�մ�������ˮ |

