题目内容
实验室中浓硫酸的商标如下图所示.请根据有关信息计算:
(1)该试剂瓶中硫酸溶液的质量是________g.
(2)欲配制100 g溶质质量分数为19.6%的稀硫酸,需这种浓硫酸多少克?
(3)取足量的稀硫酸与6.5 g锌充分反应,可制得氢气多少克?

答案:
解析:
解析:
|
根据商标提供的信息,结合所学的知识可知: (1)硫酸溶液的质量=硫酸溶液的体积×密度,即500 mL×1.84 g/cm3=920 g. (2)配制100 g溶质质量分数为19.6%的稀硫酸,需这种浓硫酸的质量为100 g×19.6%÷98%=20 g. (3)答:需这种浓硫酸的质量为20 g,可制得氢气0.2 g. 设可生成氢气的质量为x |

练习册系列答案
相关题目
实验室中浓硫酸的商标如图所示.请根据有关信息计算:
| 硫酸 化学纯(CP) (500mL) 品名 硫酸 化学式 H2SO4 相对分子质量 98 密度 1.84g/cm3 质量分数 98%(1)该试剂瓶中硫酸溶液的质量是 (2)欲配制100g溶质质量分数为19、6%的稀硫酸,需这种浓硫酸多少克? (3)取足量的稀硫酸与6.5g锌充分反应,可制得氢气多少克? |
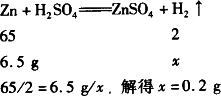
 实验室中浓硫酸的商标如右图所示:根据有关信息计算:
实验室中浓硫酸的商标如右图所示:根据有关信息计算: 19、实验室中浓硫酸的商标如图所示,根据有关信息计算:(精确到0.1)
19、实验室中浓硫酸的商标如图所示,根据有关信息计算:(精确到0.1) 实验室中浓硫酸的商标如右图所示.据此判断下列说法不正确的是( )
实验室中浓硫酸的商标如右图所示.据此判断下列说法不正确的是( )