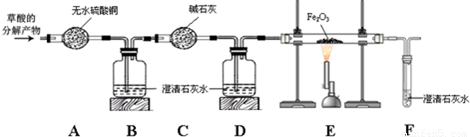
题目内容
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂.某研究性
学习小组对在空气中长期露置已变质的碱石灰样品进行如下探究.
Ⅰ.定性探究
[提出问题]碱石灰样品中可能含有哪些物质?
[猜 想]猜想一:可能含有Na2C03,作出此猜想的依据是______(用化学方程式表示).
猜想二:可能含有Ca(OH)2,作出此猜想的依据是______(用简洁的文字表述).
[设计实验]
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量样品置于试管中,加足量的水溶解,观察并用手触摸试管外壁 | 形成浊液 试管外壁发热 | 则样品中CaO 和______ 至少有一种 |
| ②将①的浊液过滤,向所得的滤液中逐滴加入氯化钙溶液至过量 | 产生白色沉淀 | 样品中含有的物质是______ |
| ③将②的浊液过滤,向所得的滤液中滴加几滴酚酞溶液 | 溶液______ | 由步骤①可知:最后滤液一定显碱性, 因此无法检验样品中的Ca(OH)2 |
[交流与讨论]
(1)小鹏同学提出:“步骤①中形成浊液,说明样品中含有碳酸钙”,你认为他的观点______(填“正确”或“不正确”).
(2)小虎同学认为本实验设计中,碱石灰样品中是否有CaC03是无法证明的.于是他和小兰,小娟认真探究,设计出了判断是否有CaC03的实验方案:他(她)们取几大块已变质的碱石灰样品,从表面刮取一定量的固体,进行______(操作方法),再将产生的气体通入澄清的石灰水,变浑浊,证明样品中有碳酸钙(提示:碳酸钠高温不分解).
Ⅱ.定量探究
[提出问题]样品中碳酸钠的质量分数的最大值是多少呢?小娟同学设计了以下方案:

则样品中Na2C03的质量分数的最大值是多少?(写出计算过程)
[交流与反思]
小兰同学认为小娟同学得到的计算结果不准确.因为稀盐酸有挥发性,可能导致测得的碳酸钠的质量分数偏大.由于挥发量不大,可以忽略不计.
解:猜想一:氢氧化钠会和二氧化碳反应产生碳酸钠和水,反应的方程式为:CO2+2NaOH=Na2CO3+H2O;
猜想二:因为氧化钙可以吸收水生成氢氧化钙,故可能含有氢氧化钙;
[设计实验]①因为氢氧化钙微溶于水、碳酸钙难溶于水都易形成浊液,故样品中至少含有Ca(OH)2、CaCO3中的一种;
②氢氧化钠、氧化钙及其变质产物中只有碳酸钠能够和氯化钙反应产生碳酸钙白色沉淀,因此样品中含有的物质是碳酸钠;
③碳酸钠和氢氧化钠溶液均显碱性;
[交流与讨论](1)因为氢氧化钙微溶于水、碳酸钙难溶于水都易形成浊液,故样品中可能含有碳酸钙,也可能是氢氧化钙,也可能是氢氧化钙和碳酸钙的混合,所以错误;
(2)根据信息提示:碳酸钠高温不分解,可以采用高温煅烧石灰石的方法证明碳酸钙的存在;
Ⅱ.定量探究 根据反应前后的质量差计算二氧化碳的质量,再根据化学方程式计算碳酸钠的质量,利用得出碳酸钠的质量分数.
由反应前混合物的总质量-反应后混合物的质量=200g+200g-397.8g=2.2g可知是产生二氧化碳的质量
假设二氧化碳全部是碳酸钠与盐酸反应产生的,则需要碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
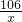 =
=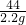 x=5.3g
x=5.3g
碳酸钠的质量分数=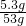 ×100%=10%
×100%=10%
答:样品中Na2C03的质量分数的最大值是10%.
故答案为:猜想一:CO2+2NaOH=Na2CO3+H2O;
猜想二:氧化钙吸收水生成氢氧化钙;
[设计实验]①Ca(OH)2、CaCO3;②Na2CO3 ;③变成红色;
[交流与讨论](1)不正确;(2)高温煅烧;
Ⅱ.定量探究
由反应前混合物的总质量-反应后混合物的质量=200g+200g-397.8g=2.2g可知是产生二氧化碳的质量
假设二氧化碳全部是碳酸钠与盐酸反应产生的,则需要碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
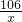 =
=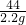 x=5.3g
x=5.3g
碳酸钠的质量分数=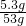 ×100%=10%
×100%=10%
答:样品中Na2C03的质量分数的最大值是10%.
分析:猜想一:氢氧化钠会和二氧化碳反应产生碳酸钠和水;
猜想二:氧化钙可以吸收水生成氢氧化钙;
[设计实验]①根据氢氧化钙微溶于水、碳酸钙难溶于水易形成浊液回答;
②氯化钙能够和碳酸钠反应产生碳酸钙白色沉淀;
③因为一定含有碳酸钠,而碳酸钠和氢氧化钙溶液均显碱性,滴加无色的酚酞试液都会变成红色,无法确定氢氧化钙的存在;
[交流与讨论](1)根据氢氧化钙微溶于水、碳酸钙难溶于水易形成浊液分析;
(2)根据信息提示:碳酸钠高温不分解,可以采用高温煅烧石灰石的方法证明碳酸钙的存在;
Ⅱ.定量探究 根据反应前后的质量差计算二氧化碳的质量,再根据化学方程式计算碳酸钠的质量,利用得出碳酸钠的质量分数.
点评:本题考查了一个氢氧化钠和氧化钙的变质的综合性问题,关键要明确变质后的产物碳酸钠和氢氧化钠的干扰,氢氧化钙和碳酸钙溶解性的干扰并进行计算.
猜想二:因为氧化钙可以吸收水生成氢氧化钙,故可能含有氢氧化钙;
[设计实验]①因为氢氧化钙微溶于水、碳酸钙难溶于水都易形成浊液,故样品中至少含有Ca(OH)2、CaCO3中的一种;
②氢氧化钠、氧化钙及其变质产物中只有碳酸钠能够和氯化钙反应产生碳酸钙白色沉淀,因此样品中含有的物质是碳酸钠;
③碳酸钠和氢氧化钠溶液均显碱性;
[交流与讨论](1)因为氢氧化钙微溶于水、碳酸钙难溶于水都易形成浊液,故样品中可能含有碳酸钙,也可能是氢氧化钙,也可能是氢氧化钙和碳酸钙的混合,所以错误;
(2)根据信息提示:碳酸钠高温不分解,可以采用高温煅烧石灰石的方法证明碳酸钙的存在;
Ⅱ.定量探究 根据反应前后的质量差计算二氧化碳的质量,再根据化学方程式计算碳酸钠的质量,利用得出碳酸钠的质量分数.
由反应前混合物的总质量-反应后混合物的质量=200g+200g-397.8g=2.2g可知是产生二氧化碳的质量
假设二氧化碳全部是碳酸钠与盐酸反应产生的,则需要碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
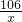 =
=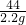 x=5.3g
x=5.3g碳酸钠的质量分数=
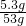 ×100%=10%
×100%=10%答:样品中Na2C03的质量分数的最大值是10%.
故答案为:猜想一:CO2+2NaOH=Na2CO3+H2O;
猜想二:氧化钙吸收水生成氢氧化钙;
[设计实验]①Ca(OH)2、CaCO3;②Na2CO3 ;③变成红色;
[交流与讨论](1)不正确;(2)高温煅烧;
Ⅱ.定量探究
由反应前混合物的总质量-反应后混合物的质量=200g+200g-397.8g=2.2g可知是产生二氧化碳的质量
假设二氧化碳全部是碳酸钠与盐酸反应产生的,则需要碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
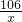 =
=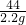 x=5.3g
x=5.3g碳酸钠的质量分数=
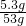 ×100%=10%
×100%=10%答:样品中Na2C03的质量分数的最大值是10%.
分析:猜想一:氢氧化钠会和二氧化碳反应产生碳酸钠和水;
猜想二:氧化钙可以吸收水生成氢氧化钙;
[设计实验]①根据氢氧化钙微溶于水、碳酸钙难溶于水易形成浊液回答;
②氯化钙能够和碳酸钠反应产生碳酸钙白色沉淀;
③因为一定含有碳酸钠,而碳酸钠和氢氧化钙溶液均显碱性,滴加无色的酚酞试液都会变成红色,无法确定氢氧化钙的存在;
[交流与讨论](1)根据氢氧化钙微溶于水、碳酸钙难溶于水易形成浊液分析;
(2)根据信息提示:碳酸钠高温不分解,可以采用高温煅烧石灰石的方法证明碳酸钙的存在;
Ⅱ.定量探究 根据反应前后的质量差计算二氧化碳的质量,再根据化学方程式计算碳酸钠的质量,利用得出碳酸钠的质量分数.
点评:本题考查了一个氢氧化钠和氧化钙的变质的综合性问题,关键要明确变质后的产物碳酸钠和氢氧化钠的干扰,氢氧化钙和碳酸钙溶解性的干扰并进行计算.

练习册系列答案
相关题目