题目内容
现有2.1g相对分子质量为28的无色可燃气体在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰(其组成为生石灰和氢氧化钠固体)吸收燃烧产物,增重9.3g.(1)计算燃烧产物中水的质量.
(2)通过计算推断该无色可燃气体的化学式.
【答案】分析:根据产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g是碳酸钙的质量,计算出二氧化碳的质量,由于碱石灰既能吸收二氧化碳又能吸收水,所以9.3g减去二氧化碳的质量就是物质燃烧生成的水的质量,再根据二氧化碳中碳元素的质量就是物质中碳元素的质量,水中氢元素的质量就是物质中氢元素的质量,再进一步进行计算.
解答:解:(1)设要生成15g沉淀需要二氧化碳的质量为x则:
CO2+Ca(OH)2═CaCO3↓+H2
44 100
x 15g
根据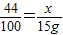 解得x=6.6g;水的质量:9.3g-6.6g=2.7g;
解得x=6.6g;水的质量:9.3g-6.6g=2.7g;
(2)根据质量守恒定律可知二氧化碳中碳元素的质量就是物质中碳元素的质量,水中氢元素的质量就是物质中氢元素的质量,该无色气体中碳元素的质量:6.6g×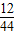 ×100%=1.8g,该无色气体中氢元素的质量:2.7g×
×100%=1.8g,该无色气体中氢元素的质量:2.7g×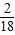 ×100%=0.3g,因为1.8g+0.3g=2.1g,所以该气体中不含有氧元素.碳元素与氢元素的原子个数比为:
×100%=0.3g,因为1.8g+0.3g=2.1g,所以该气体中不含有氧元素.碳元素与氢元素的原子个数比为: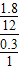 =1:2,因为该气体的相对分子质量为28,所以该气体的化学式为:C2H4.
=1:2,因为该气体的相对分子质量为28,所以该气体的化学式为:C2H4.
故答案为:(1)2.7g;(2)C2H4.
点评:解答本题关键是要知道化学反应前后元素种类不变,物质燃烧的生成物二氧化碳中碳元素的质量就是物质中碳元素的质量,水中氢元素的质量就是物质中氢元素的质量.
解答:解:(1)设要生成15g沉淀需要二氧化碳的质量为x则:
CO2+Ca(OH)2═CaCO3↓+H2
44 100
x 15g
根据
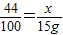 解得x=6.6g;水的质量:9.3g-6.6g=2.7g;
解得x=6.6g;水的质量:9.3g-6.6g=2.7g;(2)根据质量守恒定律可知二氧化碳中碳元素的质量就是物质中碳元素的质量,水中氢元素的质量就是物质中氢元素的质量,该无色气体中碳元素的质量:6.6g×
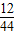 ×100%=1.8g,该无色气体中氢元素的质量:2.7g×
×100%=1.8g,该无色气体中氢元素的质量:2.7g×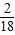 ×100%=0.3g,因为1.8g+0.3g=2.1g,所以该气体中不含有氧元素.碳元素与氢元素的原子个数比为:
×100%=0.3g,因为1.8g+0.3g=2.1g,所以该气体中不含有氧元素.碳元素与氢元素的原子个数比为: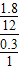 =1:2,因为该气体的相对分子质量为28,所以该气体的化学式为:C2H4.
=1:2,因为该气体的相对分子质量为28,所以该气体的化学式为:C2H4.故答案为:(1)2.7g;(2)C2H4.
点评:解答本题关键是要知道化学反应前后元素种类不变,物质燃烧的生成物二氧化碳中碳元素的质量就是物质中碳元素的质量,水中氢元素的质量就是物质中氢元素的质量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
现有一瓶标签如图所示的浓盐酸,请根据标签上的数据回答问题:
(1)要配制165g.20%的盐酸,需用该浓盐酸 mL.
(2)利用刚配制的稀盐酸来测定某碳酸盐样品的纯度(不含氢元素):取一定量该碳酸盐(R2C03)样品,向其中滴入刚配好的稀盐酸至不再产生气泡为止,共用去盐酸73g(杂质不与盐酸反应也不溶于水),然后过滤,得滤渣2.8g,将所得滤液蒸干,得到固体纯净物23.4g.
①发生反应的化学方程式. ②该样品的主要成分化学式的是
③利用已知条件求解参加反应的固体物质质量(x)的比例式
④该样品的纯度是
⑤若向反应后溶液中加入31.6g水后,此时所得溶液中溶质的质量分数为 .
| 盐酸 体积:500mL 化学式:HCl 相对分子质量:36.5 密度:1.1g/cm3 质量分数:30% |
(2)利用刚配制的稀盐酸来测定某碳酸盐样品的纯度(不含氢元素):取一定量该碳酸盐(R2C03)样品,向其中滴入刚配好的稀盐酸至不再产生气泡为止,共用去盐酸73g(杂质不与盐酸反应也不溶于水),然后过滤,得滤渣2.8g,将所得滤液蒸干,得到固体纯净物23.4g.
①发生反应的化学方程式.
③利用已知条件求解参加反应的固体物质质量(x)的比例式
④该样品的纯度是
⑤若向反应后溶液中加入31.6g水后,此时所得溶液中溶质的质量分数为
