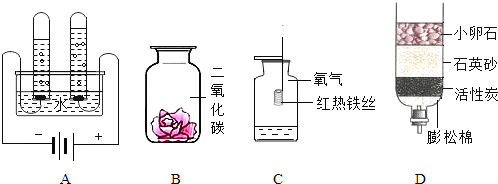
��Ŀ����
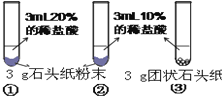
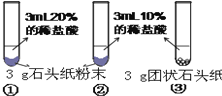
����Ŀ����ͼ1��ʾΪʵ���ҳ��õ�ʵ��װ�ã�
��1��д�������������ƣ�a ��b ��
��2��ʵ�����ø��������ȡ����ʱ��Ӧѡ��ķ���װ���� ����װ�õ���ĸ���ţ�����ѧ����ʽ�� ����˫��ˮ��ȡ�����Ļ�ѧ����ʽΪ ��
��3��ʵ������п��ϡ���ᷴӦ��ȡ�����Ļ�ѧ����ʽ�� ������Eװ�����ռ��������ų���Ӧ�� ����c��d����ͨ������ˮ��
��4��װ��C�����װ��B�ڲ������������Ϊ ��
A��������ʱ��Һ B�����Կ��Ʒ�Ӧ���� C�����Կ��Ʒ�Ӧ������ֹͣ
ͬѧ�Ƕ�������Ļ���ʯͷֽ����Ҫ�ɷ�Ϊ̼��ƣ�������������ϩ���������ϼ���չ��̽����
[��չʵ��һ]̽��Ӱ��ʯͷֽ�����ᷴӦ����������
��5���ס�����ͬѧ���ʵ�����£�
�� | �� | |
ʵ����� |
|
|
���� | �Թܢ١��ڡ����в������ݿ�����˳��Ϊ�� �٣��ڣ��ۣ� | |
�������� | ��̼�����ϡ���ᷴӦ�Ļ�ѧ����ʽΪ ��Աȼ�ͬѧʵ��٢ڿ�֪�� ����ѧ��Ӧ���ٶ�Խ�죻 ��Աȼ�ͬѧʵ�� ����ʵ����ţ���֪����Ӧ��ĽӴ����Խ��Ӧ����Խ �� ����ͬѧ��ʵ���У����ݼ�¼ֽ��Ӧ��������¼��ʵ�������� �� �� | |
[��չʵ���]�ⶨʯͷֽ��̼��Ƶ���������
��6������ͬѧ�ķ����ǣ���ͬ��ͬѹ�£���ͬ�����Ϻ�������ڻ��ǰ���������֮�ͣ���
����Ʒ��ϡ���ᷴӦ���ⶨ��Ӧ������CO2��������ٻ���Ϊ������������CO2�����������Ʒ��̼��Ƶ�������ͼ2����Ϊʯͷֽ��ϡ���ᷴӦ��װ�ã�ͼ�������ڲ���CO2�������
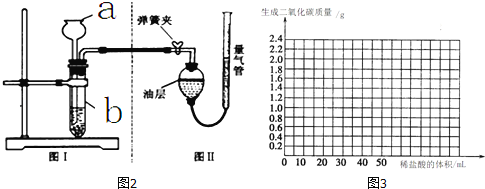
�������������н����ɼУ���a�м���һ������ˮ�����a��b�����ȶ��ĸ߶Ȳ˵����װ�ã�I�������� ��ѡ����á���©������
��ͼ����װ�����Ͳ�������� ��
�۷�Ӧֹͣ�� ������ţ���ʹ��Ӧǰ���Ͳ��Ϸ�����ѹǿ��������ѹ��ͬ����ʱ�ų�ˮ�������Ϊ���ɶ�����̼�������
A��ˮƽ�ƶ������� B�������ƶ������� C�����������
��7������ͬѧ��ʵ�鷽���ǣ����ȳ�ȡ�ķ���Ʒ�ֱ��ϡ���ᷴӦ���õ�����ƽ���й�װ�ã��ó�������̼������ʵ�����ݼ�¼���±������������ʼȲ�����ˮҲ�����ᷴӦ��
��һ�� | �ڶ��� | ������ | ���ķ� | |
ȡ��Ʒ������g�� | 6.25 | 6.25 | 6.25 | 6.25 |
ȡϡ����������mL�� | 10.0 | 20.0 | 30.0 | 40.0 |
���������������g�� | 0.88 | 1.76 | 2.20 | m |
ͨ�������ݵķ����ͱȽϣ��ش������й����⣺
���ڵ�1����Ʒ��ʵ���У� ��ȫ��Ӧ�ˣ�
��mΪ
��ʯͷֽ��Ʒ��̼��Ƶ����������Ƕ��٣�����д��������̣�
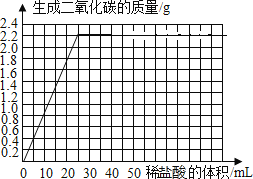
������ͼ3����ͼ�л�����6.25g��Ʒ�м���ϡ����������������������Ĺ�ϵͼ�� ��
���𰸡���1���ƾ��ƣ�����©��
��2��A��2KMnO4![]() K2MnO4+MnO2+O2����2H2O2
K2MnO4+MnO2+O2����2H2O2 ![]() 2H2O+O2��
2H2O+O2��
��3��Zn+H2SO4�TZnSO4+H2����c����4��C����5��
�� | �� | |
ʵ����� |
|
|
���� | �Թܢ١��ڡ����в������ݿ�����˳��Ϊ�� �٣��ڣ��ۣ� | |
�������� | ��̼�����ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��CaCO3+2HCl=CaCl2+H2O+CO2�� ��Աȼ�ͬѧʵ��٢ڿ�֪������ԽŨ����ѧ��Ӧ���ٶ�Խ�죻 ��Աȼ�ͬѧʵ��ڢۿ�֪����Ӧ��ĽӴ����Խ��Ӧ����Խ�죮 ����ͬѧ��ʵ���У����ݼ�¼ֽ��Ӧ��������¼��ʵ��������ʱ�䣨��ʱ��ʾ������ƿ��ҩƷ��������������ƽʾ������CO2��������ƿ��ҩƷ��������������ƽʾ������CO2������ | |
��6�����ã���ֹCO2����ˮ��B
��7�����ᣮ2.20��80%��
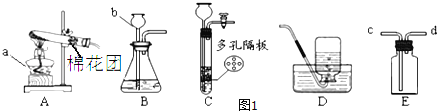
����������1��a�Ǿƾ��ƣ�b����©����
��2��ʵ�����ø��������ȡ����ʱ��Ҫ���ȣ�Ӧѡ��ķ���װ����A����ѧ����ʽ�ǣ�2KMnO4![]() K2MnO4+MnO2+O2������˫��ˮ��ȡ�����Ļ�ѧ����ʽΪ����
K2MnO4+MnO2+O2������˫��ˮ��ȡ�����Ļ�ѧ����ʽΪ����
��3��ʵ������п��ϡ���ᷴӦ��ȡ�����Ļ�ѧ����ʽ�ǣ�Zn+H2SO4�TZnSO4+H2��������Eװ�����ռ��������ų���Ӧ��c��ͨ������ˮ��
��4��װ��C�����װ��B�ڲ������������Ϊ���Կ��Ʒ�Ӧ������ֹͣ��ԭ���ǣ��رտ���ʱ���Թ��е��������࣬ѹǿ����Һ��ѹ�볤��©���������Һ����룬��Ӧֹͣ��
����ʱ�����嵼�����Թ��е�������٣�ѹǿ��С��Һ������ϣ���Ӧ���У�
��5���ס�����ͬѧ���ʵ�����£�
�� | �� | |
ʵ����� |
|
|
���� | �Թܢ١��ڡ����в������ݿ�����˳��Ϊ�� �٣��ڣ��ۣ� | |
�������� | ��̼�����ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��CaCO3+2HCl=CaCl2+H2O+CO2�� ��Աȼ�ͬѧʵ��٢ڿ�֪������ԽŨ����ѧ��Ӧ���ٶ�Խ�죻 ��Աȼ�ͬѧʵ��ڢۿ�֪����Ӧ��ĽӴ����Խ��Ӧ����Խ�죮 ����ͬѧ��ʵ���У����ݼ�¼ֽ��Ӧ��������¼��ʵ��������ʱ�䣨��ʱ��ʾ������ƿ��ҩƷ��������������ƽʾ������CO2��������ƿ��ҩƷ��������������ƽʾ������CO2������ | |
��6���������������н����ɼУ���a�м���һ������ˮ�����a��b�����ȶ��ĸ߶Ȳ˵����װ�ã�I�����������ã�
��ͼ����װ�����Ͳ�������Ƿ�ֹCO2����ˮ��
�۷�Ӧֹͣ�������ƶ������ܿ�ʹ��Ӧǰ���Ͳ��Ϸ�����ѹǿ��������ѹ��ͬ����ʱ�ų�ˮ�������Ϊ���ɶ�����̼�������
��7����ͨ����1�ݺ͵�2�ݱȽϿ��Է��֣���ϡ�������������ʱ�����������Ҳ�����ӣ�˵����1����̼���û����ȫ��Ӧ����ϡ������ȫ��Ӧ��
�ڵ�1�ݷų�������̼������0.88g��˵��ÿ����10gϡ������̼�����ȫ��Ӧ������������̼������Ϊ0.88g����2�ݼ���20g���ᣬ�ǵ�һ��ϡ����������2��������������̼������Ϊ1.76g��Ҳ���ǵ�һ�ݲ�������������2�����������ݼ���30g���ᣬ�ǵ�һ��ϡ����������3��������������̼������Ϊ2.2g��С�ڵ�һ�ݲ��������������3����0.88g��3=2.64g����˵��̼��ƴ�ʱ��ȫ��Ӧ��ϡ������ʣ�࣬����ķݵ������Ӧ����m��ֵΪ2.2��
�۽⣺��6.25g��Ʒ��CaCO3������Ϊx��
CaCO3+2HCl=CaCl2+H2O+CO2��
100 44
x 2.2g
![]() =
=![]() ��
��
��ã�x=5g��
��CaCO3������������![]() ��100%=80%��
��100%=80%��
����ʵ�����ݿ�֪����25gϡ����ʱ��̼���ǡ����ȫ��Ӧ������2.2g������̼����ͼ������ʾ��