题目内容
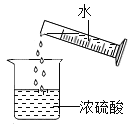
【题目】为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),用一稀盐酸进行了如下实验;
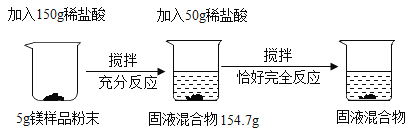
请回答下列问题:
(1)搅拌的目的是________;
(2)C中固液混合物的质量是____________;
(3)计算镁样品中镁的质量分数_________。
【答案】让盐酸和镁充分接触,加快反应速率 204.6g 96%
【解析】
(1)搅拌的目的是让盐酸和镁充分接触,加快反应速率;故填:让盐酸和镁充分接触,加快反应速率;
(2)由于所加盐酸为同一盐酸,且根据第一次150g稀盐酸完全反应生成氢气为:150g+5g-154.7g=0.3g,所以继续加入50g稀盐酸恰好完全反应,则生成的氢气的质量为0.1g,C中固液混合物的质量是154.7g+50g-0.1g= 204.6g,故填:204.6g;
(3)解:设镁样品中镁的质量分数为x,分析实验过程知道共生成氢气0.4g
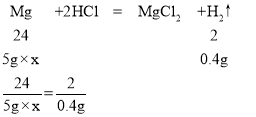
x=96%
答:样品中镁的质量分数为96%。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
【题目】工业中利用如下反应合成SO3:2SO2+O2![]() 2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A. 丁物质一定是催化剂V2O5
B. 参加反应的SO2分子、O2分子的个数比为2:1
C. 丙物质是O2
D. d=15