题目内容
已知CaCO3+H2O+CO2=Ca(HCO3)2,Ca(HCO3)2易溶于水.某实验小组在含一定量Ca(OH)2的澄清石灰水中通入CO2,产生沉淀的质量与通入CO2气体的质量的关系如图所示,回答下列问题:(1)写出OA段反应的化学方程式: .
(2)请描述整个实验过程的实验现象 .
(3)通CO2气体前石灰水中溶质的质量为 g
(4)至少通入CO2气体质量为 g时,溶液的质量是整个实验过程中溶液质量的最大值(不考虑CO2气体在水中的溶解).
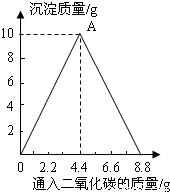
【答案】分析:当二氧化碳的质量较少时,二氧化碳与氢氧化钙反应生成碳酸钙沉淀,当二氧化碳的质量过量时,产生的碳酸钙与水和过量的二氧化碳反应,生成可溶性的碳酸氢钙,沉淀消失.
解答:解:从图示可以看出在OA段,二氧化碳与氢氧化钙反应,生成碳酸钙沉淀,到二氧化碳4.4g时,沉淀达到最大.
二氧化碳与碳酸钙恰好完全反应.再继续通二氧化碳,二氧化碳与碳酸钙和水反应,生成可溶性的碳酸氢钙,二氧化碳的量到8.8g时沉淀恰好完全反应,溶液又变澄清.
(3)设石灰水中氢氧化钙的质量为X;
CO2+Ca(OH)2=CaCO3↓+H2O
44 74
4.4g X
 =
=
X=7.4g
从图示中可以看出当二氧化碳的质量为8.8g时,溶液的质量最大.
故答案为:(1)CO2+Ca(OH)2=CaCO3↓+H2O.
(2)澄清石灰水先变浑浊后变澄清.
(3)7.4.
(4)8.8g.
点评:我们可以利用澄清的石灰水变浑浊来检验一种气体是否是二氧化碳气体,但二氧化碳的量若通过的过多,则沉淀消失,所以我们在检验二氧化碳气体时,通过二氧化碳的量要适量.
解答:解:从图示可以看出在OA段,二氧化碳与氢氧化钙反应,生成碳酸钙沉淀,到二氧化碳4.4g时,沉淀达到最大.
二氧化碳与碳酸钙恰好完全反应.再继续通二氧化碳,二氧化碳与碳酸钙和水反应,生成可溶性的碳酸氢钙,二氧化碳的量到8.8g时沉淀恰好完全反应,溶液又变澄清.
(3)设石灰水中氢氧化钙的质量为X;
CO2+Ca(OH)2=CaCO3↓+H2O
44 74
4.4g X
 =
=
X=7.4g
从图示中可以看出当二氧化碳的质量为8.8g时,溶液的质量最大.
故答案为:(1)CO2+Ca(OH)2=CaCO3↓+H2O.
(2)澄清石灰水先变浑浊后变澄清.
(3)7.4.
(4)8.8g.
点评:我们可以利用澄清的石灰水变浑浊来检验一种气体是否是二氧化碳气体,但二氧化碳的量若通过的过多,则沉淀消失,所以我们在检验二氧化碳气体时,通过二氧化碳的量要适量.

练习册系列答案
相关题目

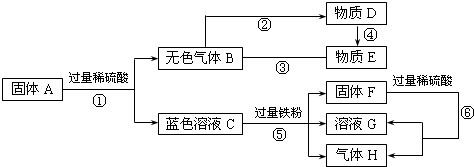
 (用化学方程式表示)
(用化学方程式表示)
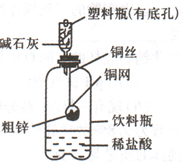 某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.按下列实验步骤进行,请填写相关内容.
某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.按下列实验步骤进行,请填写相关内容.