题目内容
【题目】某市盛产石灰石,主要成分是CaCO3.某同学为了测定石灰石中碳酸钙的质量分数进行了如下实验。取一定量的石灰石样品研碎,和100g浓度为15%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25g)。请计算:
反应时间/s | 20 | 40 | 60 | 80 | 100 |
烧杯和药品质量/g | 146.7 | 143.4 | m | 141.2 | 141.2 |
(1)表中的“m”为_____g;
(2)该石灰石样品中碳酸钙的质量分数_____。
【答案】141.2 80%
【解析】
假设反应匀速进行,所以变化量应该是一样的,根据20s~40s变化量为146.7g﹣143.4g=3.3g,则40s~60s也应该为3.3g,而80s为141.2g,143.4g-141.2g=3.2g<3.3g,即60s也为141.2g,所以m=141.2,即已经完全反应,所以开始的质量为146.7g+3.3g=150g;样品的质量为150g﹣100g﹣25g=25g。
根据质量守恒定律,二氧化碳的质量为:150g﹣141.2g=8.8g;
设该石灰石样品中碳酸钙的质量为x。
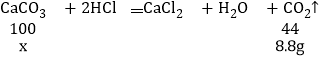
![]()
解得x=20g
该石灰石样品中碳酸钙的质量为分数为:![]() ×100%=80%
×100%=80%
答:(1)表中的“m”为 141.2g;
(2)该石灰石样品中碳酸钙的质量分数为80%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
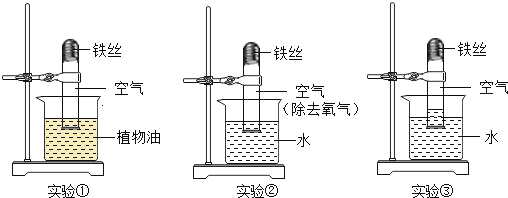
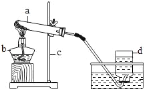
小学生10分钟应用题系列答案【题目】如图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。


【查阅资料】
常温下镁粉能与水发生置换反应,且放热。
【进行实验】
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:
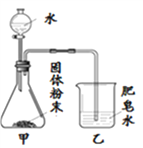
(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ______ | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解释与结论】
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2 ![]() 。
。
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
【反思改进】
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的实验方案为:取少量固体混合物________。