题目内容
【题目】高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
A | 98% | 室温 | 无 | 72s |
B | 65% | 室温 | 无 | 129s |
C | 65% | 50℃ | 无 | 16s |
D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
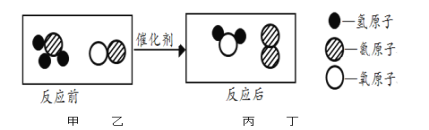
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
【答案】CO2 B 探究硫酸溶液的浓度是否影响上述反应的速率 在硫酸溶液浓度相同、不使用催化剂的条件下,温度越高反应速率越快 B D 高锰酸钾溶液浓度、草酸溶液浓度、催化剂用量、硫酸溶液用量(合理即可)
【解析】
[解释与结论]
(1)根据质量守恒定律,反应前原子种类和数目分别是2K、2Mn、10C、16H、3S、40O,反应后原子种类和数目分别是2K、2Mn、16H、3S、20O,反应前后相差10个C原子和20个O原子,碳、氧原子个数比为1∶2,故填CO2;
(2)分析四支试管,试管A探究的是硫酸浓度对反应速率的影响,试管C是溶液温度对反应速率的影响,试管D是催化剂对反应速率的影响,只有试管B是对照实验,故填B;
(3)实验A和实验B形成对比,在其它条件相同时探究硫酸浓度是否影响反应速率,故填探究硫酸溶液的浓度是否影响上述反应的速率?;
(4)通过对比实验B和实验C,在硫酸浓度和都不使用催化剂的条件下,温度越高,反应速率越快,故填在硫酸溶液浓度相同、不使用催化剂的条件下,温度越高反应速率越快;
(5)只有D试管中加入了催化剂,所以将D试管和B试管作对比,即可得出催化剂对该反应速率的影响,故填BD;
[反思与交流]
(6)上述实验中高锰酸钾溶液的用量和浓度是固定的,草酸溶液的浓度和用量也是固定的,稀硫酸的量是固定的,改变这些定量都有可能对反应速率产生影响,此外还有催化剂的用量也有可能影响反应速率,故填高锰酸钾溶液浓度、草酸溶液浓度、催化剂用量、硫酸溶液用量(合理即可)。

【题目】小明进行H2O2溶液制O2的实验探究。结合下列过程,回答有关问题。
(1)MnO2作催化剂,向5mL5%的H2O2溶液中加入少量MnO2,立即产生大量气泡。
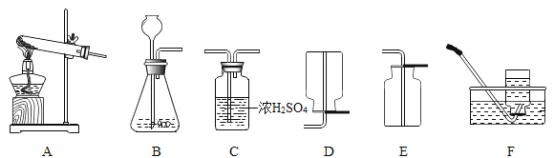
①写出用H2O2溶液制备O2的化学方程式:______。
②己知,浓硫酸常用于干燥气体。用上述反应原理制备并收集一瓶干燥的O2,从所给装置图中选择并组装一套装置,其连接顺序为______→______→______(填标号)。
(2)FeCl3溶液做催化剂,向5mL5%的H2O2溶液中加入2滴一定浓度的FeCl3溶液,立即产生大量气泡。
(已知)FeCl3溶液中主要含有三种微粒:H2O、Fe3+、Cl-
(问题)哪种微粒对H2O2溶液的分解起催化作用?
(假设)假设一:可能是H2O 假设二:可能是Fe3+ 假设三:可能是Cl-
(分析)①假设一不可能成立,理由是______。
(实验)
操作 | 现象 |
其他条件不变,向H2O2溶液中加入NaCl溶液 | 无明显变化 |
其他条件不变,向H2O2溶液中加入Na2SO4溶液 | 无明显变化 |
其他条件不变,向H2O2溶液中加入Fe2(SO4)3溶液 | 立即产生大量气泡 |
(结论)②假设______成立,而假设和另一种假设不成立。
(3)催化剂比较
从循环利用的角度分析,______(填化学式)更适合做该反应的催化剂。