题目内容
【题目】根据如图所示装置回答问题: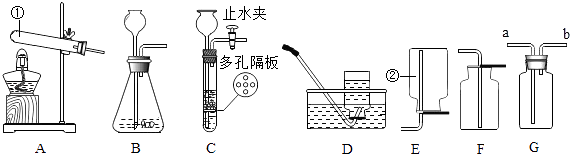
(1)写出下列仪器的名称:①② .
(2)实验室若用B装置来制取二氧化碳,应往长颈漏斗中入 , 若用G装置来收集二氧化碳,二氧化碳应从进入(选“a”或“b”).如果选择装置C制取二氧化碳,与B装置相比,其优点是: .
(3)用不加催化剂的方法制取氧气,选择的发生装置是 , 反应的化学方程式;若选择G装置(事先装满水)收集氧气,则氧气应从通入(选“a”或“b”).
(4)某化学兴趣小组欲测定一块石灰石样品中碳酸钙的质量分数(假设样品中的杂质不溶于水也不与盐酸反应).将15.0g石灰石样品放入烧杯中,再取100g稀盐酸分4次加入烧杯中,每次均充分反应.实验数据记录如下:
次 数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸质量/g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量/g | m | 61.4 | 85.6 | 110.6 |
试计算:
①生成二氧化碳的总质量 g
②第1次加入稀盐酸充分反应后,烧杯中物质的总质量m为
(5)③该石灰石样品中碳酸钙的质量分数(写出计算过程).
【答案】
(1)试管;集气瓶
(2)稀盐酸;a;可以控制反应的发生和停止
(3)A;2KMnO4 ![]() K2MnO4+MnO2+O2↑;b
K2MnO4+MnO2+O2↑;b
(4)4.4;38.2
(5)
解:设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+ | CO2↑ |
100 | 44 |
X | 4.4g |
![]() =
= ![]()
x=10g
碳酸钙的质量分数为: ![]() ×100%=66.7%
×100%=66.7%
答:碳酸钙的质量分数为66.7%
【解析】解:(1)通过分析题中所指仪器的作用可知,①是试管,②是集气瓶;(2)碳酸钙和盐酸反应制取二氧化碳时,应往长颈漏斗中入稀盐酸,二氧化碳密度比空气大,所以用G装置来收集二氧化碳,二氧化碳应从a进入,选择装置C制取二氧化碳,与B装置相比,其优点是:可以控制反应的发生和停止;(3)实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,所以选择的发生装置是A,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4 ![]() K2MnO4+MnO2+O2↑,氧气密度比水小,不易溶于水,所以选择G装置(事先装满水)收集氧气,则氧气应从b通入;(4)①生成二氧化碳的质量为:15g+100g﹣110.6g=4.4g;②通过表中数据可知,第三次加入稀盐酸后,反应后烧杯中物质的总质量仍然减少,说明第1、2次反应中,碳酸钙足量,与稀盐酸反应生成的二氧化碳质量相等,第1、2次生成的二氧化碳质量为:15.0g+50g﹣61.4g=3.6g,每次生成的二氧化碳质量为1.8g,所以m的值是:25g+15g﹣1.8g=38.2g;
K2MnO4+MnO2+O2↑,氧气密度比水小,不易溶于水,所以选择G装置(事先装满水)收集氧气,则氧气应从b通入;(4)①生成二氧化碳的质量为:15g+100g﹣110.6g=4.4g;②通过表中数据可知,第三次加入稀盐酸后,反应后烧杯中物质的总质量仍然减少,说明第1、2次反应中,碳酸钙足量,与稀盐酸反应生成的二氧化碳质量相等,第1、2次生成的二氧化碳质量为:15.0g+50g﹣61.4g=3.6g,每次生成的二氧化碳质量为1.8g,所以m的值是:25g+15g﹣1.8g=38.2g;
所以答案是:(1)试管,集气瓶;(2)稀盐酸,a,可以控制反应的发生和停止(3)A,2KMnO4 ![]() K2MnO4+MnO2+O2↑,b;(4)①4.4;②m=38.2;③石灰石样品中碳酸钙的质量分数为66.7%.
K2MnO4+MnO2+O2↑,b;(4)①4.4;②m=38.2;③石灰石样品中碳酸钙的质量分数为66.7%.
【考点精析】利用书写化学方程式、文字表达式、电离方程式和根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知注意:a、配平 b、条件 c、箭号;各物质间质量比=系数×相对分子质量之比.